Akku se on järjestelmä, jossa kemiallinen energia muuttuu spontaanisti sähköenergiaksi.
Vuonna 1836 englantilainen kemisti ja meteorologi John Frederic Daniell (1790-1845) rakensi paalun, joka poikkesi tuolloin tunnetusta: Alessandro Volta -paalu. Tässä kasassa hän toisiinsa kytketyt kaksi elektrodia, jotka olivat järjestelmiä, jotka koostuivat metallista, joka oli upotettu tämän metallin kationien muodostaman suolan vesiliuokseen.
Yksi elektrodeista, kuparielektrodi, koostui kuparilevystä, joka oli kastettu kuparisulfaattiliuokseen (CuSO4). Toinen elektrodi oli sinkkielektrodi, joka koostui sinkkisulfaatista (ZnSO4) upotetusta sinkkilevystä.
Nämä kaksi elektrodia oli kytketty toisiinsa sähköpiirillä, joka sisälsi lampun, koska jos se syttyi, se merkitsisi sähkövirran syntymistä.
Niiden välillä oli myös suolasilta. Tämä silta koostui U: n muotoisesta lasiputkesta, joka sisälsi väkevästi liukoisen suolan, kuten esimerkiksi kaliumkloridin (KCl (vesipitoinen)) väkevöity vesiliuos. Putken päät on päällystetty puuvillalla tai agarilla.
Alla on tämän solun tai sähkökemiallisen kennon rakenne, joka tunnettiin nimellä Daniell-solu. Muista, että kutakin elektrodia kutsutaan puolikennoksi.
Kun piiri on suljettu, lamppu syttyy ja jonkin ajan kuluttua sinkkilevy on syöpynyt ja sen massa on pienentynyt, kun taas kuparilevy on päinvastainen, sen massa kasvaa (kuten alla olevassa kuvassa on esitetty). On myös huomattava, että Zn-ionien konsentraatio mol / l on lisääntynyt2+ ja Cu-ionien väheneminen2+.
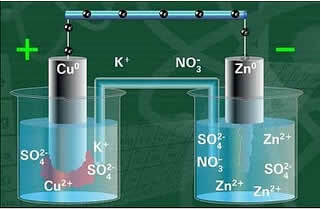
Daniell's Stack -kaavio.
Miksi tämä tapahtuu?
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Ymmärtääksemme katsotaan reaktioita, jotka tapahtuvat kullakin elektrodilla erikseen.
Sinkkielektrodissa tapahtuu seuraava tasapainoreaktio:
Zn (s) ↔ Zn2+(tässä) + 2 ja-
Tämä tarkoittaa, että metallinen sinkki (levystä) hapettuu, eli se luovuttaa kaksi elektronia sinkkikationille (liuoksesta) ja tulee Zn2 +: ksi. Tapahtuu myös päinvastainen, liuoksessa oleva sinkkikationi ottaa vastaan kaksi sinkin luovuttamaa elektronia ja muuttuu metalliseksi sinkiksi. Siksi tapahtuu keskeytymätön hapetus- ja pelkistysprosessi.
Sama pätee kuparielektrodiin, jolla on globaali reaktio dynaamisessa tasapainossa: Cu (s) ↔ Cu2+(tässä) + 2 ja-
Daniell tajusi, että jos hän kytkisi nämä kaksi elektrodia, reaktiivisempi lahjoittaisi elektroninsa vähemmän reaktiiviseen kationiin sen sijaan, että tekisi sen omassa ratkaisussa olevien kationien kanssa. Tässä tapauksessa sinkki on kaikkein reaktiivisin ja hapettuu luovuttaen elektroneja kuparille, mikä vähentää sen massaa. Hapettuva elektrodi on negatiivinen napa, jota kutsutaan anodiksi. Kuparielektrodi on se, joka pelkistyy, kuparikationi vastaanottaa elektronit sinkiltä ja sitä kutsutaan katodiksi (positiivinen napa).
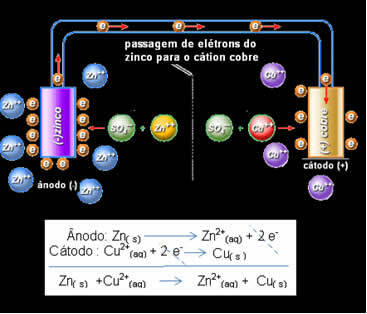
Elektronien kulku ja Daniellin pinon globaali yhtälö.
Yllä on tämän pinon yleinen yhtälö, joka saadaan lisäämällä kaksi puolireaktiota. Sen esitys tai kemiallinen merkintä tehdään seuraavan säännön mukaisesti:

Joten Daniellin pinoa varten meillä on:
Zn / Zn2+// Perse2+ / perse
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Brasilian koulutiimi
Fysikaalis-kemiallinen - Kemia - Brasilian koulu
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Danill's Pile"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Pääsy 28. kesäkuuta 2021.


