Entsyymit ovat biologisia katalyyttejä, jotka ovat vastuussa tietyn kemiallisen reaktion nopeuden lisäämisestä. Entsyymit ovat yleensä proteiineja, mutta on joitain ribonukleiinihapot jotka toimivat entsyymeinä, joita kutsutaan ribotsyymeiksi.
Reaktion nopeuttamiseksi entsyymien on sitoututtava reagensseihin, jotka tunnetaan substraateina. Pitkän ajan tämän linkin uskottiin esiintyvän hyvin jäykällä tavalla, kuvio, joka tunnetaan nimellä näppäinlukko. tällä hetkellä, Kuitenkin, indusoiduksi sovitukseksi kutsuttu malli hyväksytään., joka olettaa, että entsyymin muodossa tapahtuu pieniä muutoksia, kun substraatti tulee aktiiviseen kohtaan.
Lue myös: Mikä on aineenvaihdunta?
Mitä entsyymit ovat?
Entsyymit ovat biomolekyylejä, jotka toimivat katalysaattoreina, toisin sanoen ne ovat - aineet, jotka pystyvät kiihdyttämään nopeutta kemialliset reaktiot joita esiintyy elävissä olennoissa kuluttamatta näitä reaktioita. Ilman entsyymien vaikutusta jotkut reaktiot olisivat hyvin hitaita, mikä vahingoittaisi aineenvaihduntaa. Entsyymit nopeuttavat selektiivisesti reaktioita ja ovat siksi hyvin spesifisiä katalyyttejä.
Entsyymit pystyvät nopeuttamaan reaktiota vähentämällä aktivointienergiaa, toisin sanoen ne vähentävät energian määrää, joka on lisättävä reaktion alkamiseksi.
[julkaisu_omnia]
Onko jokainen entsyymi proteiini?
Vaikka ne määritellään usein proteiiniluonteisiksi biologisiksi katalysaattoreiksi, kaikki entsyymit eivät ole proteiineja. On joitain RNA: ita, jotka toimivat kuten entsyymit, joita kutsutaan ribotsyymeiksi. Suurin osa entsyymeistä on kuitenkin proteiineja, joita muodostuu siis aminohappoja. Näiden biomolekyylien aminohappokoostumus määrittelee kolmiulotteisen rakenteen, jonka se hankkii.
Lue myös: Kuinka katalysaattorit toimivat?
Entsyymi-substraattikompleksi
Sitä kutsutaan reagenssisubstraatiksi, johon entsyymi vaikuttaa. Kun entsyymi sitoutuu substraattiinsa, kompleksi muodostuu entsyymisubstraatti. Tämä sitoutuminen tapahtuu tietyllä alueella, jota kutsutaan aktiiviseksi alueeksi.
Kun puhumme proteiinipohjaisista entsyymeistä, aktiivinen kohta vastaa vain muutamia aminohappoja, ja loput molekyylistä on vastuussa aktiivisen kohdan konfiguraation määrittämisestä. Aktiivisen kohdan muoto sekä substraatin muoto liittyvät entsyymin spesifisyyteen, koska niiden on oltava toisiaan täydentäviä.
Avainlukitusmalli
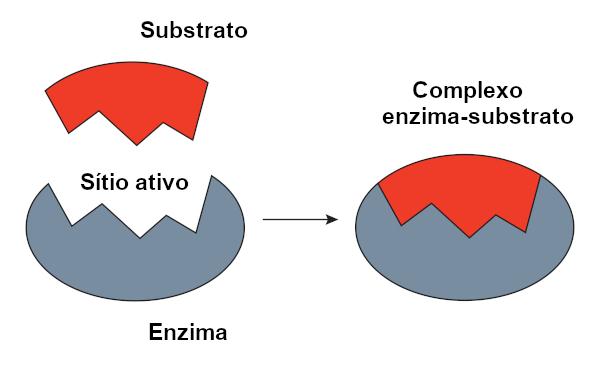
O avaimen lukitusmalli, jota ehdotti Emil Fischer, käytetään laajalti selittämään entsyymin ja substraatin välistä vuorovaikutusta. Tämän mallin mukaan entsyymin ja substraatin välillä on jäykkä komplementaarisuus, aivan kuten avain ja lukko. Entsyymin aktiivisella kohdalla olisi täydentävä muoto substraatille, joka sopisi täydellisesti. Muilla molekyyleillä ei siis ole pääsyä tähän kohtaan, mikä takaisi entsyymin spesifisyyden. Aivan kuten avain avaa vain lukon, entsyymi sitoutuu vain substraattiin. Tänään tiedämme kuitenkin, että tämä malli ei ole oikea, koska entsyymit eivät ole jäykkiä rakenteita, kuten aiemmin ajateltiin.
Indusoitu sovitusmalli
Tällä hetkellä hyväksytty malli entsyymin ja sen substraatin välisen yhteyden selittämiseksi on yksi napsahtaa aiheuttama, jonka alun perin ehdottivat Koshland et ai. Aktiivinen kohta ja substraatti eivät toimi jäykästi kuin avain ja lukko. Tutkimukset osoittavat, että kun substraatti tulee aktiiviseen kohtaan, entsyymissä tapahtuu pieni modifikaatio, joka suosii aktiivisen kohdan ja substraatin välistä sovitusta. Tämän mallin ymmärtämiseksi paremmin voimme ajatella entsyymin ja substraatin vuorovaikutusta kädenpuristuksena, joka vahvistuu ensimmäisen kosketuksen jälkeen.
Kofaktorit
Useimmat entsyymit tarvitsevat apumolekyylejä katalyyttisen toimintansa suorittamiseksi, joita kutsutaan kofaktoreiksi. Kofaktorit voidaan kiinnittää pysyvästi entsyymiin tai ne voidaan kiinnittää heikosti ja palautuvasti substraattiin. He myös voi olla epäorgaanista tai orgaanista. Kun kofaktorit ovat orgaanisia molekyylejä, niitä kutsutaan koentsyymit.
Jonkin verran vitamiineja toimivat koentsyymeinä, kuten esimerkiksi riboflaviini, joka tunnetaan myös nimellä B2-vitamiini. Esimerkkeinä epäorgaanisista kofaktoreista voidaan mainita rauta ja sinkki niiden ionimuodossa.
Lue myös: B-kompleksiset vitamiinit - ryhmä vitamiineja, jotka yleensä toimivat koentsyymeinä
Entsyymiluokitus
Entsyymit voidaan luokitella kuusi ryhmää, käyttäen kriteerinä reaktiotyyppiä, jota ne katalysoivat.
Oksidoreduktaasit: entsyymit, jotka liittyvät oksirvähentäminen.
Transferaasit: katalysoida ryhmien siirtymistä yhdestä toiseen.
Hydrolaasit: katalysoida hydrolyysireaktioita.
Liases: toimia lisäämällä ryhmiä kaksoissidoksiin tai poistamalla kaksoissidoksen muodostavat ryhmät.
Isomeraasit: katalysoida isomerointireaktioita.
Linkit: entsyymit, jotka aiheuttavat molekyylin hajoamisen ATP, käyttämällä tässä reaktiossa vapautunutta energiaa uusien yhdisteiden muodostamiseksi.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Tekijät, jotka säätelevät entsyymiaktiivisuutta
Entsyymin aktiivisuuteen vaikuttavat tekijät, joista tärkeimmät ovat lämpötila ja pH. Lämpötilalla on yleensä positiivinen rooli kemiallisissa reaktioissa, mikä lisää entsymaattisen reaktion nopeutta. Kuitenkin, kun lämpötila kasvaa yli optimaalisten olosuhteiden, reaktionopeus laskee huomattavasti. Tämä johtuu proteiinien denaturoitumisesta. Useimpien ihmisen entsyymien optimaalinen lämpötila on välillä 35–40 ºC. Lämpötilan lisäksi pH se vaikuttaa myös entsymaattiseen aktiivisuuteen, ja sillä on myös optimaalinen arvo. Useimpien entsyymien optimaalinen pH-arvo on välillä 6-8.
Kirjailija: Vanessa Sardinha dos Santos
Biologian opettaja
