Klo molekyylien väliset voimat ovat kemian aihe, joka voi varmasti esiintyä kansallisessa lukiokokeessa (Ja joko). Siksi kannattaa tarkistaa tämän aiheen pääsisältö tässä artikkelissa.
Määritelmä
molekyylien väliset voimat ne ovat vaihtelevalla voimakkuudella (heikko, keskitaso tai voimakas) sähköstaattisen vetovoiman voimia tai sidoksia, jotka ovat muodostuneet aineen molekyylien välille ja jotka ylläpitävät niiden välistä liitosta.
Molekyylien välisten voimien tyypit
) Indusoitu dipoli
Ja molekyylien välinen voima joka tapahtuu aineen molekyylien välillä, jolla on ei-polaarinen ominaisuus. Se tapahtuu esimerkiksi sellaisten aineiden molekyylien välillä kuin O2, H2, ei2, CO2, CH4.
Näiden molekyylien välinen liitos tapahtuu, kun niiden välille syntyy dipoli. Tämä tapahtuu, kun yhden molekyylin elektronit syrjäyttävät toisen elektroneja, jolloin syntyy negatiivinen ja positiivinen napa, joka siirtyy yhdestä molekyylistä toiseen.
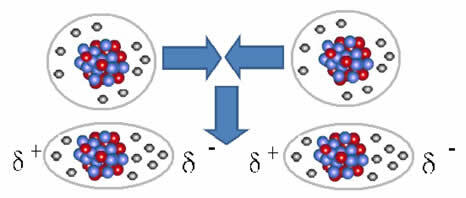
Esitys dipolin muodostumisesta ei-polaarisissa molekyyleissä
Näiden molekyylien välille muodostui kaksi napaa, ja toisen negatiivinen napa on vuorovaikutuksessa toisen positiivisen napan kanssa. Koska nämä navat luotiin, se on pienitehoinen molekyylien välinen voima.
B) pysyvä dipoli
Ja molekyylien välinen voima joka tapahtuu polaarisen ominaisuuden omaavan aineen molekyylien välillä. Esimerkkejä ovat sellaisten aineiden molekyylit kuin HCN, H2O, NH3, CO, CH3Cl.
Näiden molekyylien välinen liitos tapahtuu, kun toisen negatiivinen napa on vuorovaikutuksessa toisen positiivisen napan kanssa.
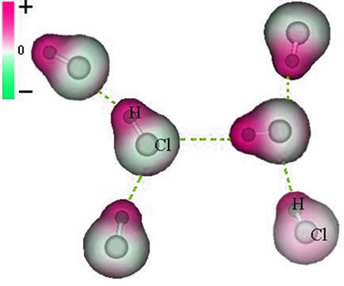
HCl-molekyylien välisen pysyvän dipolivoiman esitys
Koska pylväät ovat jo olemassa, pysyvä dipolin välinen molekyylien välinen voima on voimakkaampaa kuin indusoitu dipoli.
ç) vetysidokset
Että molekyylien välinen voima se tapahtuu polaaristen molekyylien välillä, joissa vetyatomi on sitoutunut suoraan happi-, typpi- tai fluoriatomiin.
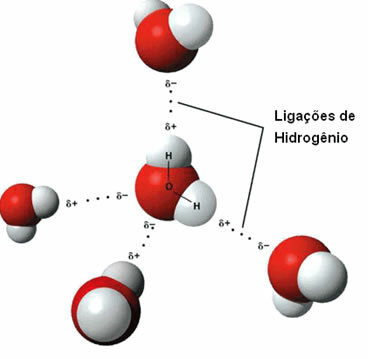
Edustus vetysidoksista vesimolekyylien välillä
Vetysidos muodostuu, kun yhden molekyylin vety on vuorovaikutuksessa toisen molekyylin hapen, typen tai fluorin kanssa.
d) dipoli-ioni
Tämä molekyylien välinen voima tapahtuu polaarisen molekyylin, jolla on pari sitoutumattomia elektroneja, ja ionin (kationin tai anionin) välillä liuoksessa.
Esimerkiksi vesimolekyylissä on kaksi paria sitoutumattomia elektroneja hapessa. Jos vesipitoisessa väliaineessa on ioneja, ne lähestyvät vesimolekyyliä, koska siinä on napoja.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Merkitys
Tietämyksen tärkeys molekyylien väliset voimat Enemille se on ymmärrys, jonka he tuovat aineiden fysikaalisista tiloista, sulamispisteestä, kiehumispisteestä ja liukoisuudesta.
) Suhde aineen sulamis- ja kiehumispisteeseen
Sulamispiste osoittaa lämpötilan siirtymisestä kiinteästä tilasta nestemäiseen tilaan ja kiehumispiste osoittaa lämpötilan siirtymisestä nestemäisestä kaasumaiseen tilaan.
Tämä kohta liittyy suoraan aineen molekyylien väliseen vuorovaikutukseen, koska mikä erottaa yhden fyysisen tilan toisesta, on sen molekyylien välinen aggregaatiotaso.
Siten mitä voimakkaampi molekyylien välinen voima on, sitä korkeammat sulamis- ja kiehumispisteet. Mitä vähemmän voimakas molekyylien välinen voima on, sitä alhaisemmat sulamis- ja kiehumispisteet. Siten voimme määritellä sulamis- ja kiehumispisteen laskevan järjestyksen:
Vetysidos> pysyvä dipoli> indusoitu dipoli
B) Suhde liukoisuuteen
Meidän on yleensä tiedettävä, että samanlainen liukenee kuten, toisin sanoen, napa-aine liuottaa polaarisen aineen ja ei-polaarinen aine liukenee ei-polaarisen aineen.
Liuenneiden molekyylien ja liuotinmolekyylien välillä on kuitenkin edelleen mahdollisuus vuorovaikutukseen. Tämä tapahtuu vain, jos tämä uusi vuorovaikutus on suurempi kuin mitä itse aineen molekyylien välillä jo on.
Esimerkki molekyylien välisen voiman käytöstä Enemissä
1. esimerkki: (Enem-2011) Hyvin kosteutettuna ihmisen iho saavuttaa hyvän elastisuuden sekä pehmeän ja sileän ulkonäön. Toisaalta, kun se on kuiva, se menettää joustavuutensa ja näyttää läpinäkymättömältä ja karkealta. Ihon kuivumisen estämiseksi on mahdollisuuksien mukaan käytettävä kosteuttavia kosteusvoiteita, jotka on yleensä valmistettu glyseriinistä ja polyetyleeniglykolista:

Kosteusvoiteiden edistämä veden pidättyminen ihon pinnalla on seurausta kostutusaineiden hydroksyyliryhmien vuorovaikutuksesta ympäristön sisältämän kosteuden kanssa seuraavien kautta:
a) ionisidokset
b) Lontoon joukot
c) kovalenttiset sidokset
d) dipoli-dipoli voimat
e) vetysidokset
Vastaus tähän kysymykseen on vetysidos, koska vesimolekyyli on vety sitoutunut happiatomiin. Sama tapahtuu propyleeniglykolin ja polyetyleeniglykolin molekyylien kanssa, mikä on suotuisa edellytys tämän tyyppisen molekyylien välisen voiman esiintymiselle.
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Intermolekulaariset voimat vihollisissa"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Pääsy 27. kesäkuuta 2021.


