Kuten tekstit osoittavat "Kemiallisten alkuaineiden sähkömagneettinen spektri"ja"Päästö- ja absorptiospektrit ja Kirchhoffin lait”, Kunkin kemiallisen alkuaineen epäjatkuvat emissiospektrit ovat erilaiset.

Joten alla meillä on erilliset spektrit joistakin näistä elementeistä:

Niinpä tanskalainen fyysikko Niels Böhr (1885-1962) tajusi, että tämä voi liittyä näiden elementtien atomirakenteeseen. Joten hän ehdotti atomimallia, joka täydentäisi Rutherfordin mallia, mutta keskittyi ympäröivien elektronien käyttäytymiseen atomin ytimessä.
Jonkin aikaa aiemmin Max Planck (1858-1947) oli ehdottanut teoriaa, että elektronit ovat kvantitoitu, siinä mielessä, että he päästävät ja absorboivat tiettyjä määriä energiaa, ikään kuin ne olisivat pieniä energiapakettejajonka hän kutsui kuinka paljon (kvantti, yksikössä).
Siksi Böhr ehdotti seuraavaa: koska jokaisella elementillä on erilainen spektri, jokaisen elementin atomissa on vakioita ja erilaisia energioita elementeistä toiseen.
Jokainen elektroni voi pysyä vain tietyllä tietyllä kiertoradalla, koska kullakin näistä kiertoradoista elektronilla on vakio, hyvin määritelty ja ominainen energia. Elektroni voi käyttää vain niitä energiatasoja, joille sillä on vastaava energia.
Spektrit ovat epäjatkuvia, koska elektronit kvantisoidaan.
Elektroni voi muuttaa tasoja vain, jos se absorboi energiaa. Esimerkiksi kun poltat natriumsuolaa Bunsen-polttimessa, annat energiaa elektronille. Kun absorboidaan energiakvantti, elektroni hyppää toiselle energeettisemmälle tasolle pysyen viritetyssä tilassa. Perustila on kuitenkin vakaampi, joten tämä elektroni lähettää absorboituneen energian ja palaa alkuperäiselle kiertoradalleen. Se lähettää tämän energian sähkömagneettisten aaltojen muodossa, jotka voidaan visualisoida valon muodossa. Natriumin tapauksessa tämä valo on voimakkaasti keltaista. Siten kun nämä aallot kulkevat prisman läpi, saadaan epäjatkuva natriumspektri.
Joten Böhrille, kukin alkuaineiden epäjatkuvassa spektrissä esiintynyt valoisa viiva osoitti energiaa, joka vapautui, kun elektroni palasi yhdeltä ulommalta tasolta lähemmäksi ydintä.
Alla oleva kuva auttaa ymmärtämään tätä ongelmaa paremmin:
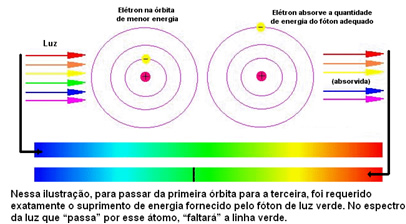
Koska kunkin elementin atomit ovat sallittuja vain tietyt energia-arvot, jotka vastaavat energiakerroksia, kullekin elementille on eri spektri.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm

