Kaasu ja höyry
Ero kaasun ja höyryn välillä on annettu kriittisestä lämpötilasta. Höyry on ainetta kaasumaisessa tilassa, tilassa, joka voidaan nesteyttää kasvavalla paineella. Kaasu ei ole sama. Se on neste, jota ei voida nesteyttää yksinkertaisella paineen nousulla. Tämä tekee kaasusta erilaisen kuin höyry.
Kaasujen käyttäytyminen
Annettu kaasumaisessa tilassa oleva aine on kaasu, jos sen lämpötila on korkeampi kuin kriittinen lämpötila, jos lämpötila on yhtä suuri tai alempi kuin kriittinen lämpötila, jolloin aine on höyryä.
Todellisilla kaasuilla, joita normaalisti tiedämme, kuten heliumilla, typellä ja hapella, on kummallakin erilaiset ja erityiset molekyyliominaisuudet. Kuitenkin, jos laitamme ne kaikki korkeisiin lämpötiloihin ja mataliin paineisiin, ne alkavat näyttää hyvin samanlaista käyttäytymistä. Kaasujen tutkimuksessa käytetään yksinkertaista teoreettista mallia, jota käytännössä ei ole, käyttäytymällä samanlaisesti kuin todelliset kaasut. Tämä likiarvo paranee, mitä alhaisempi paine ja korkeampi lämpötila. Tätä kaasumallia kutsutaan
Noin 1600- ja 1800-luvuilla kolme tutkijaa (Jacques Charles, Louis J. Gay-Lussac ja Paul E. Clayperon), tutkittuaan kaasujen käyttäytymistä, kehitti lait, jotka säätelivät täydellisten kaasujen käyttäytymistä, joita kutsutaan myös ihanteellisiksi kaasuiksi. Niiden määräämät lait asettavat täydellisen kaasun "ulkoisen" käyttäytymisen säännöt, jotka johtavat se laskee vain niihin liittyvät fyysiset määrät, jotka ovat: tilavuus, lämpötila ja paine.
Täydellisten kaasujen yleinen laki
Ilmaisu, joka määrittää täydellisten kaasujen yleisen lain, voidaan nähdä seuraavasti:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
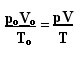
missä sO, VO ja TO ovat vastaavasti alkupaine, alkutilavuus ja alkulämpötila. Tätä lauseketta käytetään, kun kaasun muuttujat vaihtelevat.
Boylen laki
Fyysikko ja kemisti Robert Boyle määritteli lain, joka hallitsee kaasun läpi tapahtuneita muutoksia, kun sen lämpötila pidetään vakiona. Hänen lainsa mukaan kaasun isotermisen muutoksen aikana sen paine on kääntäen verrannollinen miehitettyyn tilavuuteen. Tästä laista saamme, miten TO = T Meidän täytyy:
POVO = pV
Charlesin laki
Kaarlen laki on laki, joka säätelee täydellisen kaasun muuttumista vakiomääräksi. Näitä transformaatioita kutsutaan isokoorisiksi tai isometrisiksi transformaatioiksi. Tämän lain mukaan, kun täydellinen kaasumassa käy läpi isokoorisen muutoksen, sen paine on suoraan verrannollinen sen absoluuttiseen lämpötilaan. Matemaattisesti tämä laki voidaan ilmaista seuraavasti:

missä sO ja TO ovat vastaavasti alkupaine ja alkulämpötila.
Gay-Lussacin laki
Gay-Lussacin laki on laki, joka hallitsee täydellisen kaasun muunnoksia jatkuvassa paineessa. Fyysikko ja kemisti A.C. Charles oli jo löytänyt tämän lain Gay-Lussac-nimestä huolimatta. Lain mukaan, kun kaasu muuttuu isobaarisesti, kaasun tilavuus on suoraan verrannollinen sen absoluuttiseen lämpötilaan. Matemaattisesti tämä laki voidaan ilmaista seuraavasti:

Missä VO ja TO vastaavat vastaavasti alkutilavuutta ja alkulämpötilaa.
Kirjoittanut Marco Aurélio da Silva
Katso lisää!!
Kaasun muunnokset
Tiedä mitä kaasumuunnokset ovat.
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
SANTOS, Marco Aurélio da Silva. "Kaasujen tutkimus"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Pääsy 27. kesäkuuta 2021.