Teksti "Molekyyli epäsymmetristen hiili- ja optisten isomeerien kanssa"Osoitti, että kun molekyylissä on vain yksi asymmetrinen tai kiraalinen hiili (kaikkien ligandien kanssa) eroaa toisistaan), sillä on kaksi optisesti aktiivista isomeeriä ja yksi optisesti inaktiivinen isomeeri (seos raseeminen).
Tarkastellaan nyt tapausta, jossa on kaksi tai useampaa erilaista epäsymmetristä hiiltä, toisin sanoen niitä pidetään erilaisina, koska ainakin yksi niiden ligandeista ei ole sama. Harkitse esimerkiksi aspartaamin kaavaa, joka on 180 kertaa makeampi kuin sakkaroosi (sokeri) ja jota käytetään siksi keinotekoisissa makeutusaineissa:
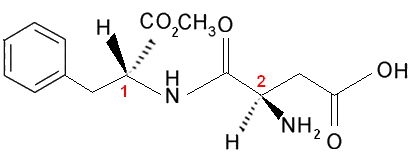
Huomaa, että tällä molekyylillä on kaksi kiraalista hiiltä, jotka tunnistetaan kuvassa numeroilla 1 ja 2. Näillä hiileillä on neljä sidosryhmää, jotka eroavat toisistaan, joten niitä pidetään epäsymmetrisinä. Kun verrataan hiililigandeja 1 hiilen kanssa 2, näemme, että ainoa toistuva ligandi on H (vety), joka on siten erilainen epäsymmetrinen hiili.
Tällä molekyylillä ja kaikilla, joilla on kaksi epäsymmetristä hiiltä, on aina:
4 optisesti aktiivista isomeeriä ja 2 optisesti inaktiivista isomeeriä (kaksi raseemista seosta).Tiedämme tämän, koska mahdolliset todennäköisyydet ovat:

Muut isomeeriparit ovat diastereoisomeerejä (jotka eivät ole toistensa peilikuvia), kuten oikeakätisen hiili-1: n ja oikeakätisen hiili-2: n seos.
Olisi kuitenkin hyvin vaikeaa, jos joudumme jatkuvasti tarkastelemaan kaikkia mahdollisuuksia jokaiselle molekyylille, koska monilla on 3, 4, 5 tai enemmän epäsymmetrisiä hiilejä.
Siten helpoin tapa määrittää molekyylin, jolla on useita, optisesti aktiivisten ja inaktiivisten isomeerien määrä erilaiset epäsymmetriset hiilet ovat alla esitettyjen matemaattisten lausekkeiden kautta, joita Van’t Hoff ja Le ehdottivat Bel:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
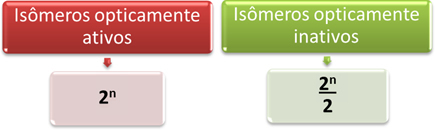
Missä ”n” on erilaisten epäsymmetristen hiilien määrä molekyylissä. Esimerkiksi aspartaamin tapauksessa se on kaksi epäsymmetristä hiiltä, joten meillä on:
- Optisesti aktiiviset isomeerit: 2ei = 22 = 4;
- Optisesti inaktiiviset isomeerit: 2ei = 22 = 2.
2 2
Se antoi täsmälleen määrän, jonka mainitsimme aiemmin.
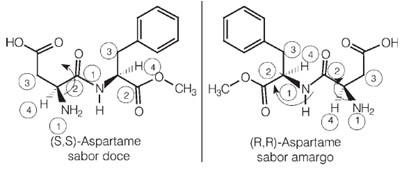
Mielenkiintoista on, että yhdellä aspartaamin enantiomeereistä on tämä makea maku, jota käytetään keinotekoisissa makeutusaineissa, mutta yhdellä sen optisista isomeereista on katkeran maku.
Katsotaan nyt toista esimerkkiä, fruktoosimolekyyli:
OH O H OH OH OH
│ ║ │ │ │ │
H C ─ C ─ Ç ─ Ç ─ Ç ─ C ─ H
│ │ │ │ │
H OH H H H
Fruktoosilla on kolme epäsymmetristä hiiliatomia, joten meillä on 8 optisesti aktiivista isomeeriä ja 4 optisesti inaktiivista isomeeriä, jotka ovat 4 raseemista seosta.
- Optisesti aktiiviset isomeerit: 2ei = 23 = 8;
- Optisesti inaktiiviset isomeerit: 2ei = 23 = 4.
2 2
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Isomeerit molekyyleissä, joissa on erilaisia asymmetrisiä hiilejä"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/isomeros-moleculas-com-carbonos-assimetricos-diferentes.htm. Pääsy 28. kesäkuuta 2021.


