valenssikerros se on atomin uloin kerros (tai taso) (kauimpana ytimestä), toisin sanoen ydin, joka on kauimpana ytimestä. Siksi sillä on niin sanotut uloimmat elektronit tai valenssielektronit.
Atomilla voi olla tasojen lukumäärä 1-7, joilla on seuraavat alatasot (keltaisena):
taso K (1. kerros): alataso s
taso L (2. kerros): alatasot s ja P
taso M (3. kerros): alatasot s, P ja d
taso N (4. kerros): alatasot s, P, d ja f
taso O (5. taso): alatasot s, P, d ja f
P-taso (6. taso): alatasot s, P ja d
taso Q (1. kerros): alatasot s ja P
Kullakin alatasolla on erilainen määrä elektroneja. Katso:
alatasolla s on enintään 2 elektronia;
alatasolla p on enintään 6 elektronia;
alatasolla d on enintään 10 elektronia;
alatasolla f mahtuu enintään 14 elektronia.
Siten, jos tietyn atomin valenssikuori on M, suurin mahdollinen elektronien määrä siinä on 18 (2 elektronia alatasosta + 6 elektronia alatasosta + 10 elektronia alataso d).
Määritetään atomin valenssikuori ja kuinka monta elektronia sillä on kaksi tapaa, nimittäin:
→ Valenssikuoren ja sen elektronien lukumäärän määrittäminen elektronisesta jakelusta
Sähköinen jakelu tapahtuu aina Linus Pauling -kaavioedustettuina alla:

Linus Pauling -kaavion esitys
Tavallinen atomiluku (mikä osoittaa elektronien määrän atomissa), teemme elektronisen jakelun. Esimerkiksi atomiluvun 50 atomi:

Elektroninen atomiluvun atomin jakauma on 50
Analysoimalla yllä olevaa jakaumaa, meillä on, että ytimestä kauimpana oleva taso on viides (N-taso), jossa meillä on 4 elektronia (kaksi s-alatasossa ja 2 p-alatasossa).
→ Valenssikuoren ja sen elektronien lukumäärän määrittäminen jaksollisesta taulukosta
Taulukko on järjestetty jaksoihin (vaakasuorat sarakkeet), jotka osoittavat atomin tasojen määrän ja ryhmät tai perheet (pystysarakkeet). Aikaa käytetään määrittämään valenssikerros, ja perheitä käytetään elektronien lukumäärän määrittämiseen.
a) Tietäen kemiallisen alkuaineen jakson
Jaksollisessa taulukossa on yhteensä seitsemän jaksoa, mikä määrä liittyy Linus Pauling -kaaviossa esiintyvien tasojen määrään. Joten, jos tiedämme ajanjakson, jolloin kemiallinen alkuaine se on taulukossa automaattisesti, tiedämme kuinka monta tasoa atomeillasi on, valenssikerros on taso kauimpana ytimestä.
Ensimmäinen esimerkki: Kemiallinen alkuaine Kalium
Kalium on jaksollisen jakson neljännellä jaksolla, joten sen atomilla on neljä tasot, neljäs taso on valenssikerros, joka vahvistetaan sen jakautumisen kautta elektroniikka.
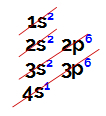
Kaliumelementin sähköinen jakelu
Toinen esimerkki: Kemiallinen alkuaine Fluori
Fluori on jaksollisen jakson toisessa jaksossa, joten sen atomilla on kaksi tasot, toinen taso on valenssikerros, joka vahvistetaan sen jakautumisen kautta elektroniikka.

Fluori-elementin sähköinen jakelu
Kolmas esimerkki: Indium-kemiallinen alkuaine
Intialainen on jaksollisen jakson viidennessä jaksossa, joten hänen atomillaan on viisi tasot, viides taso on valenssikerros, joka vahvistetaan sen jakautumisen kautta elektroniikka.

Indium-elementin sähköinen jakelu
b) Kemiallisen alkuaineen perheen tai ryhmän tunteminen
Kun tiedämme perheen tai ryhmän, johon elementti on sijoitettu, tiedämme myös kyseisen elementin valenssikuoressa olevien elektronien määrän.
Perheen A osat
Perheiden A elementit on sijoitettu jaksollisen järjestelmän sarakkeisiin 1, 2, 13-18. Kukin näistä sarakkeista saa numeron (1-8, roomalainen numero), joka osoittaa tarkalleen elektronien lukumäärän näiden elementtien valenssikuoressa:
Sarake 1 - IA-perhe = kaikilla on 1 elektroni valenssikuoressa;
Sarake 2 - perhe IIA = kaikilla on 2 elektronia valenssikuoressa;
Sarake 3 - perhe IIIA = kaikilla on 3 elektronia valenssikuoressa;
Sarake 4 - IVA-perhe = kaikilla on 4 elektronia valenssikuoressa;
Sarake 5 - VA-perhe = kaikilla on 5 elektronia valenssikuoressa;
Sarake 6 - VIA-perhe = kaikilla on 6 elektronia valenssikuoressa;
Sarake 7 - perhe VIIA = kaikilla on 7 elektronia valenssikuoressa;
Sarake 8 - perhe VIIIA = kaikilla on 8 elektronia valenssikuoressa.
Katso joitain esimerkkejä A-ryhmän joidenkin elementtien valenssielektronien määrän määrittämisestä:
Esimerkki 1: kemiallinen alkuaine barium
Barium sijaitsee IIA-perheessä, joten sillä on kaksi elektronia valenssikuoressa, mikä vahvistetaan sen elektronisella jakelulla:

Barium-elementin sähköinen jakelu
Esimerkki 2: Antimoni kemiallinen alkuaine
Antimoni sijaitsee VA-perheessä, joten sen valenssikuoressa on viisi elektronia, minkä vahvistaa sen elektroninen jakelu:

Antimoni-elementin sähköinen jakelu
Esimerkki 3: Ksenon kemiallinen alkuaine
Xenon sijaitsee VIIIA-perheessä, joten sen valenssikuoressa on kahdeksan elektronia, mikä vahvistetaan sen elektronisella jakelulla.

Xenon-elementin sähköinen jakelu
HUOMAUTUS: Ainoa A-perheeseen kuuluva kemiallinen alkuaine, joka ei noudata ehdotettua sääntöä, on helium. Se kuuluu VIIIA-perheeseen, mutta valenssikuoressa on vain kaksi elektronia. Tämä johtuu siitä, että sen atomiluku on 2, joten on mahdotonta, että valenssikuoressa on 8 elektronia kuten muut perheen elementit.
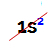
Heliumatomin sähköinen jakelu
Perheen B elementit
Perheiden B elementit on sijoitettu jaksoittaisen taulukon sarakkeisiin 3-12. A-perheiden lisäksi on myös kahdeksan B-perhettä, joita edustaa roomalaiset numerot. Toisin kuin A-perheet, B-perheen lukumäärä ei määritä elektronien määrää valenssikuoressa.
B-ryhmän elementin valenssikuoressa olevien elektronien määrä on aina yhtä suuri kuin 2, atomiluvusta ja sijainnista taulukossa riippumatta. Kaliforniumin (98CF) ja hassius (108hs) todista tämä:
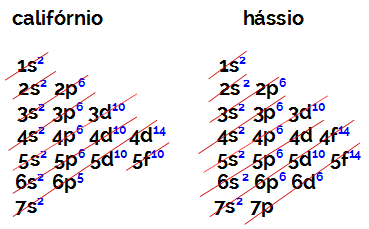
Kaliforniumin elektronisella jakelulla on energisimpänä alatasona 5f10ja hassiuksen o on 6d6. Molemmissa tapauksissa ytimestä kauimpana oleva alataso on seitsemäs taso, ja molemmilla on kaksi hajautunutta elektronia.
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-camada-valencia.htm


