O lasketaan atomihiukkasten lukumäärä käytetään osoittamaan missä tahansa atomissa tai ionissa olevien protonien (ytimessä), elektronien (elektropallossa) ja neutronien (ytimessä) määrän. Tätä varten on välttämätöntä tietää joitain atomien ominaisuuksia:
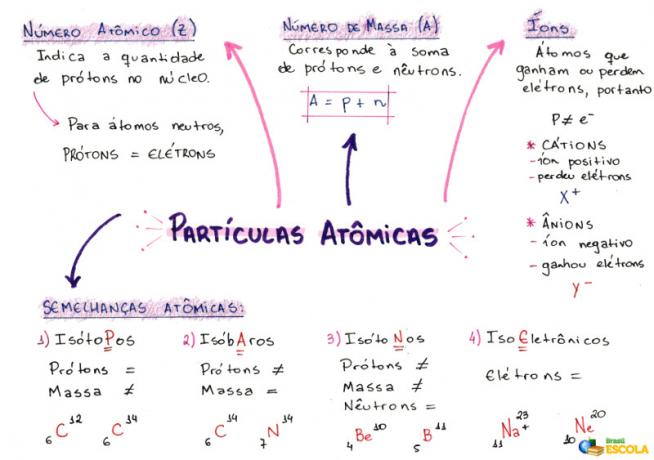
1- Atomiluku (Z)
Se on matemaattinen koodi, jota edustaa iso kirjain Z, joka sijaitsee atomin lyhenteen vasemmassa alakulmassa:
ZX
Se osoittaa protonien lukumäärän (p) ytimessä ja elektronien lukumäärän (e) atomin sähköpallossa. Joten yleisesti:
Z = p = e
2- Massanumero (A)
Se on matemaattinen koodi, joka vastaa minkä tahansa atomin ytimessä olevien protonien (p) ja neutronien (n) lukumäärän summaa. Massalukua edustava yhtälö saadaan:
A = p + n
Koska protonien lukumäärä on yhtä suuri kuin atomiluku, voimme kirjoittaa yhtälön massanumeron laskemiseksi seuraavasti:
A = Z + n
Jos tiedämme atomin massan ja atomiluvun, voimme määrittää neutronien lukumäärän seuraavasti:
n = A - Z
3- ioneja
Ne ovat atomeja, jotka menettävät tai hankkivat elektroneja. Heillä on positiivinen tai negatiivinen merkki sijoitettu edustuksensa oikeaan yläkulmaan, kuten seuraavassa mallissa:
X+ tai X-
Positiivinen ioni: Tätä kutsutaan kationiksi ja positiivinen merkki osoittaa, että se on menettänyt elektroneja.
Negatiivinen ioni: Tätä kutsutaan anioniksi ja negatiivinen merkki osoittaa, että se on saanut elektronia.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
4- Atomiset yhtäläisyydet
a) Isotoopit
Atomit, joilla on sama atomiluku ja erilaiset massanumerot. Esimerkki:
7X14 ja 7Y16
Atomeilla X ja Y on sama atominumero (lyhenteen vasemmalla puolella) eli 7. Atom X: n massanumero (lyhenteen oikealla puolella) on 14, ja atomin Y massanumero on 16.
b) Isobarit
Atomit, joilla on sama massanumero ja erilaiset atomiluvut. Esimerkki:
15X31 ja 13Y31
Atomien X ja Y massanumero (lyhenteen oikealla puolella) on 31. Toisaalta Atom X: llä on atomiluku yhtä suuri kuin 15 ja atomilla Y on atomiluku 13.
c) Isotonit
Atomit, joilla on erilaiset massanumerot ja atomiluvut, mutta sama määrä neutroneja.
d) Isoelektroniikka
Atomit, joilla on sama määrä elektroneja. Esimerkki:
12X+2 ja 7Y-3
Atom X: n atomiluku on 12 ja se on kationi (positiivisella varauksella +2), joten se menettää kaksi elektronia, jolloin sillä on 10 elektronia ilmakehässä. Atomilla Y on sen sijaan atomiluku yhtä suuri kuin 7 ja se on anioni (negatiivisella varauksella -3), joten se saa kolme elektronia, jolloin sen elektronikehässä on 10 elektronia.
Miellekartta: Atomic Particles
* Voit ladata mielikartan PDF-muodossa. Klikkaa tästä!
Esimerkkejä atomihiukkasten määrän laskemisesta
Esimerkki 1: Määritä atomien protonien, neutronien ja elektronien määrä 14X29.
Annettiin seuraavat arvot atomille X:
Massanumero (oikeassa yläkulmassa) = 29
Atomiluku (alhaalla vasemmalla) = 14
Protonien lukumäärän määrittäminen:
Protonien määrä on aina yhtä suuri kuin atomiluku, joten X-atomissa on 14 protonia.
Elektronien lukumäärän määrittäminen:
Koska atomi X ei ole ioni, elektronien lukumäärä on yhtä suuri kuin protonien lukumäärä eli 14.
Neutronien lukumäärän määrittäminen:
Neutronien määrä määritetään käyttämällä massan ja protonien lukumäärää seuraavassa kaavassa:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
Esimerkki 2: Määritä ionien X protonien, neutronien ja elektronien määrä+3tietäen, että niiden massaluku on vastaavasti 51 ja atomiluku 23.
Annettiin seuraavat arvot ionille X:
Massaluku = 51
Atomiluku (vasen alakulma) = 23
Protonien lukumäärän määrittäminen:
Protonien lukumäärä on aina yhtä suuri kuin atomiluku, joten X-atomissa on 23 protonia.
Elektronien lukumäärän määrittäminen:
Ioni X on positiivinen (+3), joten se on kationi, joka on menettänyt kolme elektronia. Joten sen elektronien lukumäärä on 20.
MERKINTÄ: Elektronien määrän väheneminen tai kasvu tapahtuu aina suhteessa atomilukuun.
Neutronien lukumäärän määrittäminen:
Neutronien määrä määritetään käyttämällä massan ja protonien lukumäärää seuraavassa kaavassa:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Esimerkki 3: Atomilla W on atomiluku ja massa yhtä suuri kuin vastaavasti 29 ja 57, koska ne ovat paljaita a: sta atomi Y, jonka atomiluku on yhtä suuri kuin 30, joka on atomin B isotooppi, jonka massanumero on 65. Määritä näiden tietojen perusteella atomien B protonien, neutronien ja elektronien määrä.
Harjoituksen antamat tiedot:
Atom W
atominumero (vasen alakulma) = 29
massanumero (oikeassa yläkulmassa) = 57
Y-isobaari, ts. Y: n massa on myös 57.
Y-atomi
atomiluku = 30
massaluku = 57
Näillä kahdella arvolla meidän on määritettävä sen neutroniluku, koska se on elementin B isotoni:
A = Z + n
57 = 30 + n
57-30 = n
n = 27
Atomi B:
massaluku = 65
neutronien lukumäärä = 27
Näiden tietojen perusteella meidän on määritettävä sen atomiluku, koska sen avulla määritämme sen protonien ja elektronien lukumäärän (koska se ei ole ioni):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Siksi atomissa B on 38 protonia, 38 elektronia ja 27 neutronia.
* Victor Ricardo Ferreiran miellekartta
Kemian opettaja
Minun luona. Diogo Lopes Dias