Molekyylien polaarisuus on erittäin tärkeä näkökohta, koska aineiden ominaisuudet määräytyy muiden tekijöiden lisäksi se, että niiden molekyylit ovat polaarisia tai ei-polaarisia.
Molekyylin polariteetti voidaan määrittää käyttämällä Dipolihetki tai Tuloksena oleva dipolihetki, jonka symboli on 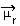 . Jos puhumme vain molekyylin jokaisen sidoksen dipolimomentista, symboli on kreikkalainen kirjain mi (µ).
. Jos puhumme vain molekyylin jokaisen sidoksen dipolimomentista, symboli on kreikkalainen kirjain mi (µ).

Molekyyli on ei-polaarinen, jos dipolimomentti on yhtä suuri kuin nolla, mutta jos se ei ole nolla, se tarkoittaa, että se on polaarinen.

Tämän tuloksena olevan dipolimomentin määrittämisessä on otettava huomioon kaksi tärkeää asiaa. Katsotaanpa, mitä ne ovat:
1) elektronegatiivisuuden ero reaktiossa mukana olevien alkioiden atomien välillä. Esimerkiksi HF-molekyylillä on huomattava ero elektronegatiivisuudessa, koska fluori houkuttelee sidoksessa olevan elektroniparin paljon enemmän kuin vetyä. Siten varausten jakautuminen ei ole symmetrinen sähköisten dipolien kanssa.
Tätä dipolia edustaa vektori, joka on päin päin, joka keskittyy eniten elektroneja, toisin sanoen vähiten elektronegatiiviseen atomiin. Joten tässä tapauksessa vektori, joka on ainoa, on tuloksena oleva vektori, kuten alla on osoitettu:
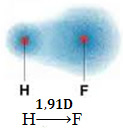
Huomaa, että vektoriarvo on sama kuin dipolimomentti, joka ilmoitetaan debye-yksikössä (D = 3,33. 10-30 coulomb. metro). Koska dipolimomentti ei ole nolla, molekyyli ja sidos ovat polaarinen.
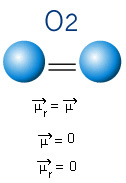
Alla olevassa molekyylissä meillä on myös molekyyli, jossa on vain kaksi atomia, mutta tässä tapauksessa se vastaa yksinkertaista ainetta, toisin sanoen sen muodostaa vain yhden tyyppinen alkuaine. Siksi ei ole elektronegatiivisuuseroa; atomit houkuttelevat myös symmetrisesti jakautuneita elektroneja. Tuloksena oleva dipolimomentti on yhtä suuri kuin nolla, joten sekä sidos että molekyyli ovat apolaarinen.
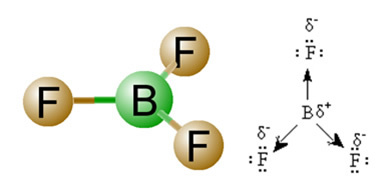
2) Molekyyligeometriaeli vektorien avaruusjärjestely. BF-molekyyli3 sillä on kolme polaarista sidosta, joissa fluori on kaikkein elektronegatiivisin, jolloin vektorit on suunnattu siihen. Koska atomien spatiaalinen järjestely on kuitenkin trigonaalinen tasainen, tämä saa elektronit symmetrisesti jakautumaan keskiatomin ympärille. Siten tulos on, että nämä kolme vektoria kumoavat toisensa ja dipolimomentti on nolla. Siksi BF-molekyyli3 é anteeksi.
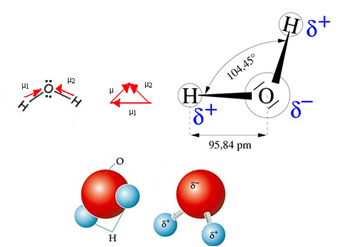
Vesimolekyylillä on kaksi vektoria, mutta sen spatiaalinen geometria ei ole tasainen, vaan V: n muotoinen. Huomaa seuraavassa kuvassa, että tällä tavalla niiden vektorit eivät peruuta toisiaan, elektronit jakautuvat epäsymmetrisesti ja keskittyvät enemmän elektronegatiivisimpaan atomiin, joka on happi. Siten dipolimomentti eroaa nollasta ja vesimolekyyli on polaarinen:
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/momento-dipolar-resultante.htm

