Energiasisemine on summa kineetilised energiad ja keha koostisosade aatomite ja molekulide liikumisega seotud potentsiaal. Sisemine energia on ka otseselt proportsionaalne energiaga temperatuur keha. See on skalaarne suurus, mida mõõdetakse džaulides (SI) ja mis määratakse selliste muutujate funktsioonina nagu surve (P), helitugevus (V) ja temperatuur süsteemi termodünaamika (T), kelvinites (K).
Mida kõrgem on keha temperatuur, seda suurem on selle sisemine energia, seda suurem on tema võime mõnda tööd teha. Pealegi annab monoatoomiliste gaaside siseenergia näiteks ainult summaarne summa kineetiline energia gaasi iga aatomi kohta. Molekulaarsete gaaside, näiteks diatoomsete gaaside käsitlemisel tuleb arvestada molekulaarsete vastastikmõjudega ja see, siseenergia määratakse molekulide kineetilise energia summa ja nende vahel oleva potentsiaalse energia summaga nad.
Ärge lõpetage kohe... Peale reklaami on veel;)
Ideaalsete monoatomiliste gaaside siseenergia
Kuna ideaalse monoatomilise gaasi aatomite vahel puudub vastastikmõju, sõltub selle siseenergia eranditult kahest muutujast: moolide arvust (n) ja gaasi temperatuurist (T). Vaata:
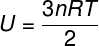
U - sisemine energia
ei - muttide arv
R - ideaalsete gaaside universaalne konstant
T - temperatuur
Ülaltoodud võrrandis R selle moodul on 0,082 atm. L / mol K või 8,31 J / mol. K (SI). Samuti võime ülaltoodud võrrandi kirjutada ka muude suuruste, näiteks rõhu ja mahu järgi. Selleks peame meeles pidama Clapeyroni võrrand, mida kasutatakse ideaalsete gaaside jaoks.
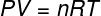
Asendades ülaltoodud võrrandi eelmisega, on meil siseenergia arvutamiseks järgmine avaldis:
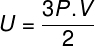
Vaataka:Mis on täiuslik gaas?
Eespool toodud võrrandeid arvesse võttes on võimalik kindlaks teha ideaalse monoatoomse gaasi aatomite kineetilise energia ja selle temperatuuri suhe. Selleks kinnitame, et seda tüüpi gaaside kineetiline energia on puhtaltkineetika. Vaata:
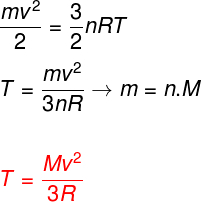
m - pasta
ei - moolinumber
M - molaarmass
Paljudes olukordades on huvitav teada, kuidas arvutada gaasi siseenergia (ΔU) variatsioon, kuna see kogus näitab, kas gaas on saanud või andis järele energia. Kui gaasi siseenergia variatsioon on olnud positiivne (ΔU> 0), on gaas energiat saanud; muidu (ΔU <0) on gaas osa energiast loobunud.
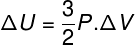
Sisemine energia varieerumine gaasimahu muutuste osas.
Diatoomsete gaaside siseenergia
Ideaalsete diatoomsete gaaside korral annab siseenergia veidi erinev võrrand.
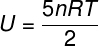
Siseenergia termodünaamilistes teisendustes ja tsüklites
Vastavalt 1. termodünaamika seadus, võib ideaalse gaasi siseenergia teatud varieeruda termodünaamilised teisendused, sõltuvalt ümbruse ja süsteemi vahel vahetatavast soojushulgast, samuti süsteemi poolt või süsteemiga tehtavast tööst.
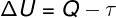
Q - soojus
τ - töö
Järgmisena vaatame, mis vormis see seadus mõne konkreetse termodünaamilise teisenduse korral võtab.
Vaataka:Soojusmasinate ajalugu
→ Siseenergia: isotermiline muundumine
Kell isotermiline muundumine, temperatuuri muutust ei toimu ja seetõttu jääb siseenergia konstantseks.
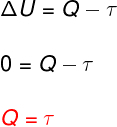
Sellisel juhul muudetakse kogu süsteemiga vahetatav soojushulk tööle ja vastupidi.
→ Siseenergia: isovolumetriline muundumine
Kell isovolumetriline muundumine, pole tööd võimalik teostada, kuna süsteem on suletud jäikusse ja laiendamatusse konteinerisse. Sellisel juhul varieerub kogu süsteemiga vahetatav soojushulk otseselt selle sisemist energiat.
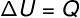
→ Siseenergia: isobaarne muundumine
Seda tüüpi muundamisel allutatakse süsteem a pidev rõhk, seetõttu saab tema või tema tehtud tööd analüütiliselt arvutada.
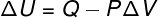
→ Siseenergia: adiabaatiline transformatsioon
Aastal adiabaatilised teisendused, ei toimu süsteemi ja selle ümbruse vahel soojusvahetust, seetõttu sõltub siseenergia varieerumine eranditult süsteemi või selle tehtud tööst.
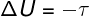
Siseenergia tsüklilistes protsessides
Igas tsüklilises protsessis on süsteemi termodünaamiline olek, mida esindavad selle rõhu, mahu ja temperatuuri muutujad (P, V, T) transformeerub, kuid jõuab lõpuks tagasi algsesse olekusse (P, V, T), seetõttu on seda tüüpi protsesside siseenergia variatsioon alati null (ΔU = 0).
Vaataka:Tsüklilised teisendused
Vaadake allolevat graafikut, mis näitab kolme erinevat termodünaamilist teisendust olekute A ja B vahel.
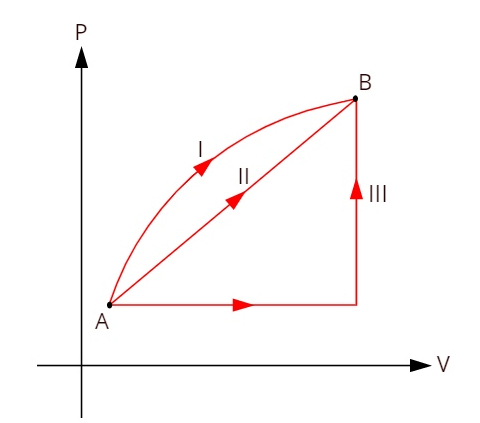
Kuna kolm teisendust (I, II ja III) lahkuvad olekust A ja lähevad olekusse B, peab sisemine energia variatsioon olema kõigi nende jaoks võrdne, seega:
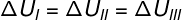
Sisemised energiaharjutused
1) Kaks mooli ideaalset diatoomilist gaasi, molaarmassiga 24 g / mol, leitakse temperatuuril 500 K suletud, jäiga mahuti sees, mille maht on 10-3 m³. Tehke kindlaks:
a) Selle gaasi siseenergia moodul džaulides.
b) Gaasi rõhk mahuti seintele.
Resolutsioon:
) Kuna see on ideaalne ja diatoomiline gaas, kasutame selle siseenergia arvutamiseks järgmist valemit:
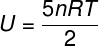
Võttes arvesse harjutusavalduses esitatud andmeid, on meil lahendada järgmine arvutus:
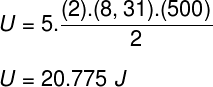
B) Gaasi avaldatava rõhu saame kindlaks määrata, kui teame selle mahuti mahtu:-3 m³. Selleks kasutame järgmist valemit:
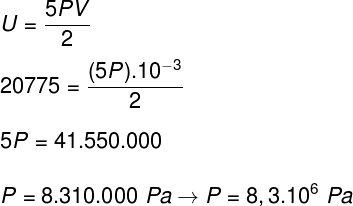
Minu poolt. Rafael Helerbrock