Kui kasutame voltmeeter akus, suudame tuvastada kahe elektroodi potentsiaali (U või ddp) või elektromotoorjõu (emf või E) erinevuse. Sellisel viisil pole aga võimalik kindlaks teha iga elektroodi redutseerimis- või oksüdeerimispotentsiaali.
Teadlased pidid oksüdatsiooni-redutseerimise protsesside uurimiseks teadma neid väärtusi, nii et nad asutasid a võrdlusolek. See tähendab, et lepiti kokku mõõta iga elektroodi potentsiaal teise elektroodi suhtes järgmistes standardtingimustes:
• temperatuur peab olema 25 ° C;
• rõhk 1,0 atm juures;
• Metalli kastetud lahuse kontsentratsioon peab olema 1,0 mol / l.
Seega oli valitud elektroodiks vesinikelektrood, mis on esindatud allpool:
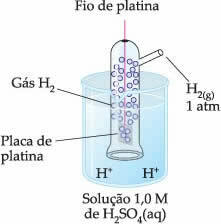
See elektrood koosneb plaatina traadist, mis on ühendatud plaatina plaadiga, mis ei osale reaktsioonis, gaasilist vesinikku sisaldavas torus, mis on sukeldatud happelisse lahusesse. Näites oli lahuseks väävelhape.
| Kokkuleppeliselt on väärtus määratud vesiniku standardelektroodile null, nii palju E-st0punane mis puutub E-sse0hapukas. |
Seega, et leida mis tahes muu elektroodi potentsiaalne väärtus, ehitame tavalise vesinikuelektroodiga lihtsalt soovitud elektroodi virna ja mõõdame ddp voltmeetri abil. Voltmeetril kuvatav väärtus on otsitava elektroodi potentsiaal, kuna vesiniku väärtus on võrdne nulliga.
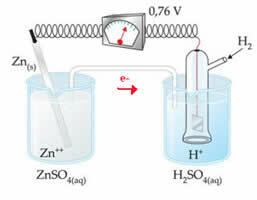
Näiteks ühendame tsingi elektroodi vesiniku elektroodiga, et teada saada, milline on selle redutseerimispotentsiaal:
Ärge lõpetage kohe... Pärast reklaami on veel rohkem;)
Vastavalt ülaltoodud skeemile tuvastas voltmeeter potentsiaalide erinevuse võrdseks +0,76 (? E0 = +0,76). Samuti märgime, et tsinkelektrood on oksüdeerunud, seega on see anood; ja vesinikelektrood redutseeritud, mis on katood.
Nii et meil on:
? E0 = E0red (katood) - E0 punane (anood)
0,76 = 0,00 - E0 punane (Zn)
E0 punane (Zn) = 0,00-0,76
E0 punane (Zn) = -0,76
Negatiivne väärtus tähendab, et elektronvool voolab tsingielektroodilt (anoodilt) vesinikuelektroodile, käitudes seega katoodina. Kui see oleks positiivne, oleks see vastupidi ja vesinikelektrood käituks nagu anood. Seda võib näha, kui ühendame vaseelektroodi tavalise vesinikuelektroodiga:
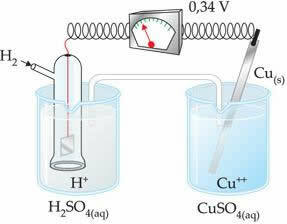
? E0 = E0red (katood) - E0 punane (anood)
-0,34 = 0,00 - E0 punane (Zn)
E0 punane (Zn) = 0,00 + 0,34
E0 punane (Zn) = +0,34
Seega on võimalik määratleda redutseerimis- ja oksüdatsioonipotentsiaal kõige erinevamate keemiliste liikide jaoks. Rahvusvaheline puhta ja rakenduskeemia liit (IUPAC) soovitab siiski kasutada ainult redutseerimispotentsiaale. Ja hoolimata kasutatud metallist, on aku esituses vesinikelektrood alati esikohal, näiteks:
Pt - H2 (g) 1atm / H3O1 + (aq) 1 mol / L // Cu2 + (aq) 1 mol / L / Cu
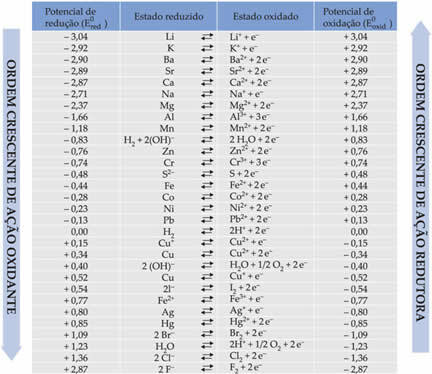
Allpool tabelis on loetletud selle vesiniku standardelektroodi kasutamise meetodil saavutatud potentsiaalid koos vastavate poolreaktsioonidega:
Autor Jennifer Fogaça
Lõpetanud keemia
Brasiilia koolimeeskond
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Elektrokeemiliste potentsiaalide mõõtmine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm. Juurdepääs 28. juunil 2021.
