Tekst Liitmisreaktsioonid näitas, et seda tüüpi orgaanilisi reaktsioone nimetatakse sel viisil, kuna orgaanilisele molekulile lisatakse reaktanti, lõhustades süsinike vahelised sidemed. Selles tekstis näidati alkeenide juhtumit, siin kaalume juba, kuidas see alküünide puhul toimub, või see tähendab nende süsivesinikega (moodustuvad ainult süsiniku ja vesiniku aatomitest), millel on side kolmekordne.
Alküünide haavatav koht on täpselt kolmekordne side, kus pi (π) -tüüpi sidemed saab ühe katkestada (liitmine osaline) või kaks korda (täielik liitmine) ja tekitavad vastavalt kaksik- (alkeen-) või üksiksidemetega uusi ühendeid (alkaanid).
Vaatame alküünide liitumisreaktsioonide juhtumeid:
1. Vesiniku lisamine või hüdrogeenimine:
Sel juhul H molekul2 lisatakse alküünile katalüsaatori abil, milleks on tavaliselt pulbristatud nikkel (Ni), plaatina (Pt) või pallaadium (Pd). Katalüsaatori kasutamise vajaduse tõttu nimetatakse seda reaktsiooni ka katalüütiline hüdrogeenimine ja see toimub järk-järgult: esimeses etapis saate alkeeni ja teises aeglasemas etapis alkaani.
Kui kasutatud katalüsaator on tugev, näiteks nikkel ja plaatina, tekib reaktsioonis otseselt alkaan. Pallaadium segatud BaSO-ga4 see on nõrk katalüsaator ja toodab alkeeni. Ainult alkeeni jõudmiseks on võimalik kasutada osalist katalüsaatori inhibiitorit. See reaktsioon toimub ka kõrgel rõhul ja temperatuuril.
Järgmisena lisame etaanile vesinikku, saades etüleeni ja seejärel etaani:

2. Halogeenide lisamine või halogeenimine:
Alküüni pi-side on katki ja molekulile lisatakse kaks halogeeniaatomit (perioodilise tabeli 17A perekonna elemendid, enimkasutatavad: Cl2 ja Br2), moodustades vicinaalse dihaliidi, mis tähendab, et kaks halogeeniaatomit on seotud naabruses asuvate süsinikuaatomitega. Reaktsioon võib jätkuda, purustades teise pi-sideme ja lisades molekulile veel kaks halogeeniaatomit.
Allpool toodud näites on altkäemaksule sellist tüüpi täiendused:
ClCl ClCl
││ ││
H ─C ≡ C CH3 + Cl2 → H ─ C ═ C CH3 + Cl2 → H ─ C ─ C CH3
││
ClCl
ALCINO DI-HALETTE TETRAHALETTE
3. Vesinikhalogeniidide lisamine (halogeenhüdriidid või vesinikhalogeenimine):
Siin lisatakse alküüni vesinikhalogeniid ja võib toimuda ka osaline ja täielik lisamine. Seda tüüpi reaktsioonide oluline aspekt on see, et see järgib Markovnikovi reegelsee tähendab, et vesinik seondub rohkem hüdrogeenitud süsinikuga (milles on rohkem vesiniku aatomeid) ja halogeen seondub vähem hüdrogeenitud süsinikuga.
Hüdrohalogeenimise käigus moodustub geeniline dihaliid, see tähendab ühend, millel on kaks halogeeniaatomit sama süsiniku külge.
Ärge lõpetage kohe... Peale reklaami on veel;)
Vaata:
HBr Hbr
││ ││
H ─C ≡ C CH3 + HBr → H ─ C ═ C CH3 + HBr → H ─ C ─ C CH3
││
Hbr
ALCINO HALIDE GEMIC DI-HALOGIID
Seda tüüpi reaktsioonide oluline näide on see, mis tekib siis, kui etüüni lisatakse vesinikkloriid, moodustades kloroeteen või vinüülmonokloriid, mis on polüvinüülkloriidi polümeeri moodustav monomeer, paremini tuntud akronüümi järgi PVC.
HClHCl
││ ││
H ─C ≡ C - H + HCl → H ─ C ═ C - H + HCl → H ─ C ─ C - H
││
HCl
ETINOKLOROETEEN-1,1-DIKLOROETAAN
(PVC monomeer)
PVC on tööstuses laialt kasutatav aine mitmesuguste toodete, näiteks sandaalide, ravimipudelite, meditsiiniseadmete, imikutele mõeldud plastpükste, kottide, traadikatted, mänguasjad, mööblipolster, autopolster, vihmamantlid, plastkingad, vinüülplaadid, põrandad, pakendikiled, veetorudes kasutatavad torud ja kanalisatsioon jne.
4. Vee lisamine (niisutamine):
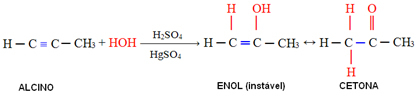
Selles reaktsioonis reageerib vesi alküüniga, moodustades esialgu enooli, mis läbib molekulaarse ümberkorralduse ja muutub aldehüüdiks (atsetüleenist väiksemate alküünide korral). Enool ja aldehüüd jäävad dünaamilises tasakaalus aldehüüdide ülekaaluga. See on juhtum Dünaamiline konstantikonaalne isomeeria või tautomeeria.
Näide:

Atsetüleenist suuremate alküünide puhul järgitakse Markovnikovi reeglit ja enool tekitab ketooni:
Autor Jennifer Fogaça
Lõpetanud keemia