THE clapeyroni võrrand on matemaatiline avaldis, mis seob suurused nagu surve (P), maht (V), temperatuur (T) ja a moodustavate osakeste arv (n) ideaalne või ideaalne gaas. See võrrand on nime saanud prantsuse füüsiku järgi Paulemileclapeyron ja seda saab mõista kui üldist empiiriliste seaduste kohta gaasidtäiuslikaastalGay-Lussac, Charles ja Boyle. See oli ideaalsete gaaside uurimisel fundamentaalne ja võimaldas Soojusmasinad, muutes need viimase paarikümne aasta jooksul üha tõhusamaks.
Vaadake ka: Füüsika avastused, mis juhtusid juhuslikult
Clapeyroni võrrand: ideaalne gaasiseadus
Clapeyroni võrrand on tuletatud kolmest empiirilisest seadusestehk seadused, mis määrati katsete põhjal. Sellised seadused selgitavad gaaside käitumist gaaside muundamineisovolumetriline (Gay-Lussaci seadus), isobaarne (Karli seadus) ja isotermid (Boyle'i seadus). Nende seaduste kohaselt:
teisendustes isovolumetriline, ideaalse gaasi rõhu ja termodünaamilise temperatuuri suhe jääb konstantseks;
teisendustes isobaarne, ideaalse gaasi mahu ja termodünaamilise temperatuuri suhe on konstantne;
- teisendustes isotermid, jääb ideaalse gaasi rõhu ja mahu korrutis konstantseks.
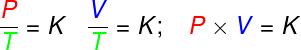
P - rõhk (Pa - pascal)
V - gaasi maht (m³)
T - termodünaamiline gaasi temperatuur (K - kelvin)
Kolme ülaltoodud seaduse põhjal määrab Clapeyroni võrrand selle väärtuse pidev (K) saadud kõigis eelpool nimetatud teisendustes. Clapeyroni võrrandi järgi on see konstant võrdne moolide arvuga, mis on korrutatud a-ga konstant R, mis on tuntud kui ideaalgaaside universaalne konstant ja võrdne väärtusega Boltzmanni konstant korrutatud Avogadro number.
Valem
Vaadake valemit, mis on tuntud kui võrrandaastalClapeyron:
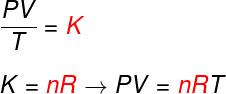
ei - moolide arv (mol)
R - ideaalsete gaaside universaalne konstant (R = 0,082 atm.l / mol. K ehk 8,314 J. mol / K)
Analüüsides Clapeyroni võrrandit, on võimalik näha, et surve ideaalsete gaaside mõjul on temperatuuriga otseselt proportsionaalne ja ka moolide arv. Lisaks rõhk on pöördvõrdeline mahuga hõivatud gaasiga.
O ideaalne gaasimudel mida Clapeyroni võrrand võimaldab töötavate masinate väljatöötamine vedelikud, näiteks aurujõul töötavad masinad ja sisepõlemismootorid.
Clapeyroni võrrandist võiks saada mitu olulist tulemust. Näiteks üks neist ennustab, et 1 mol mis tahes ideaalset gaasi mahutab 22,4 liitrit kui see on rõhu all 1 atm (1,01.105 Pa) ja temperatuuril 273K (0 ° C).
Vaadake ka: Termoloogia kõige olulisemad mõisted
Lahendatud harjutused Clapeyroni võrrandil
1. küsimus - (UECE) Gaasil, mille temperatuur, maht ja rõhk on seotud PV = nRT abil, on järgmised omadused:
a) väga suur keskmine vahemaa molekulide vahel, et mitte arvestada molekulidevaheliste interaktsioonidega, välja arvatud kokkupõrke korral; molekulid läbivad elastsed kokkupõrked.
b) väga väike keskmine vahemaa molekulide vahel; molekulid läbivad mitteelastsed kokkupõrked.
c) molekulidevaheliste interaktsioonide eiramiseks, välja arvatud kokkupõrke korral, molekulide vaheline väga suur keskmine kaugus; molekulid läbivad mitteelastsed kokkupõrked.
d) väga suur keskmine kaugus molekulide vahel ja tugev molekulidevaheline interaktsioon; molekulid läbivad elastsed kokkupõrked.
Resolutsioon:
Ideaalses gaasimudelis liigub suur hulk mõõtmeteta osakesi suure kiirusega juhuslikes suundades. Ainus koostoime, mida need osakesed kannatavad, on täiesti elastsed kokkupõrked, seega on õige alternatiiv täht a.
2. küsimus - (UFRGS) Mõelge järgmistele väidetele ideaalsete gaaside kohta.
Mina Gaaside olekuvõrrandis olev konstant R R = pR = nRT on kõigi ideaalsete gaaside jaoks sama väärtus.
II. Erinevate ideaalsete gaaside võrdne maht, samal temperatuuril ja rõhul, sisaldab sama arvu molekule.
III. Ideaalse gaasi molekulide keskmine kineetiline energia on otseselt proportsionaalne gaasi absoluutse temperatuuriga.
Millised on õiged?
a) Ainult mina
b) Ainult II
c) Ainult III
d) Ainult I ja II
e) I, II ja III
Mall:
Vaatame alternatiive:
Mina õige, seetõttu nimetatakse seda ideaalsete gaaside universaalseks konstandiks.
II. õige. Clapeyroni võrrandi kohaselt on kahel ideaalsel gaasil sama rõhk, temperatuur ja maht sama osakeste arv neis gaasides.
III. õige. Vastavalt energiajaotuse teoreemile on ideaalses gaasis olevate osakeste kineetiline energia proportsionaalne selle temperatuuriga.
Seetõttu on õige alternatiiv täht e.
3. küsimus - (UFJF) Mehed nagu Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls on muu hulgas välja töötanud olulised uuringud, mis hõlmavad gaaside omadusi. Reaalsete gaaside käitumine on ligilähedane madalrõhu tingimustes ideaalsete gaasidega, samuti suures mahus sisalduvate ja kõrgel temperatuuril hoitavate gaasidega. Mõelge, et laborikatses on mahuga V mahuti täielikult suletud ja see sisaldab 1 mooli ideaalset gaasi rõhu all 4,0 atm paisub püsival temperatuuril, mis on võrdne 127 ° C, ja et selle gaasi käitumine on ideaalse gaasi käitumine, nagu on näidatud graafiline.
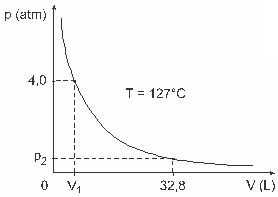
Sellisel juhul, kui gaas hõivab 32,8 l mahu, on selle rõhk järgmine:
(Arvestades: täiuslike gaaside universaalne konstant on R = 0,082 atm. L / mol K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Resolutsioon:
C-täht
Harjutuse lahendamiseks peame andmed rakendama Clapeyroni võrrandile, kuid enne seda peame temperatuuri, mis on Celsiuse kraadides, teisendama kelviniks. Kontrollige:

Autor Rafael Hellerbock
Füüsikaõpetaja
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm
