THE soolasild pakkus välja inglise keemik Frederic Daniell 1836. aastal, kui see teadlane asutas aku nime saanud tema järgi (Danilli kuhi). see sild on U-kujuline toru, millel on kaks poorset otsa. (koosneb puuvillast või agar-agarist) ja sisaldab veest ja soolast moodustunud vesilahust. See ühendab kaudselt raku kahe poolelemendi (anoodi ja katoodi) lahused.
Vaatlus: Anood on raku negatiivne poolus ja seal toimub oksüdeerumine, katood on positiivne poolus ja reduktsioon.
Soolasilla olulisuse mõistmiseks on esialgu vaja mõista vaia toimimist. Vaadake allolevat skeemi:
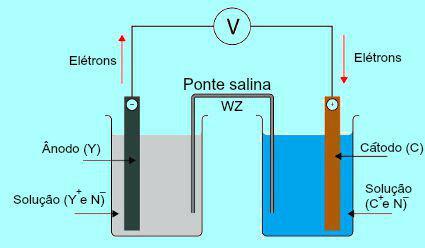
Danielli virna üldskeem
Esialgu läbib anoodis oleva plaadi metall (Y) oksüdatsiooni. Oksüdeerimisel muutub metall katiooniks, mis langeb lahusesse, milles plaat on. Sel põhjusel hakkab anoodilahus sisaldama suuremat katioonide kontsentratsiooni (Y+). Sellisel juhul täheldatakse anoodmetallplaadi vähenemist.
Y → ja- + Y+
Seejärel liiguvad anoodplaadi metalli oksüdeerimisel kaotatud elektronid läbi välise elektrijuhtme ja lähevad katoodis olevale metallplaadile. Seega laetakse katoodi juures olev plaat elektronidega.
-
Käesolevad katioonid (C+) lahuses liikuda katoodplaadi suunas, kuna see on laetud elektronidega. Katioonid muutuvad plaadil olevate elektronide omandamisel neutraalseks (stabiilseks ja tahkeks) ja kleepuvad sellele. Sel põhjusel on katoodilahuses suurem anioonide kontsentratsioon kui katioonides. Sel juhul täheldatakse katoodi metallplaadi suuruse suurenemist.
Ärge lõpetage kohe... Peale reklaami on veel;)
Ç+ + ja- → C
Alates arusaamast, kuidas Danielli hunnik, on võimalik täheldada, et anoodis olev lahus saab suurema hulga Y-katioone+ X-plaadi metalli oksüdeerumise tõttu. Katoodis olev lahus seevastu kaotab katioonid (C+), kuna nad kannatavad naastude vähenemise all.
Just selles küsimuses tõstetakse esile soolasilla tööd. Selle silla peamine ülesanne on edendada nii anood- kui ka katoodilahuses esinevate laengute tasakaalu. Soolasillas on meil alati vees dissotsieerunud sool (tavaliselt kaaliumkloriid või ammooniumnitraat.). Vaadake võrrandi kujutist soolasillas:
WZ + H2O → W+ + Z-
Soolasillas on kaks iooni (W+ ja Z-), mis nihutatakse katoodile ja anoodile vastavalt:
) Anood võtab vastu anioone (Z-), mis on soolasillas elemendi (Y) oksüdeerumise tõttu, mis põhjustab katioonide hulga suurenemist (Y+) lahuses.
B) Katood võtab vastu katioone (W+), kuna aku töötamise ajal katioon (C+) lahuses sisalduv kogus väheneb tahvlil. Seega on katoodilahuses suurem kogus anioone (N-) ja saab seetõttu soolasillas oleva katiooni.
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Purjesild"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Juurdepääs 28. juunil 2021.


