Üks liitmisreaktsioon on keemiline protsess, mille käigus orgaanilisele molekulile lisatakse anorgaanilise aine aatomeid, millel peab olema üks järgmistest omadustest:
Avatud struktuur, mis sisaldab sidumist või pi lingid;
Küllastatud suletud struktuur (ainult koos sigmalingid);
Suletud küllastumata struktuur (pi- või aromaatse sidemega).
Nende omadustega orgaanilised ühendid on järgmised Süsivesinikud:
alkeenid;
Alküünid;
Alkadieenid;
Jalgratturid;
Tsiklid;
Aroomid.
Ajal liitmisreaktsioon, üks või mitu pi-sidet või sigmaside (ainult tsüklani puhul) on katki põhjustades kaasatud süsinikele kahe või enama vaba valendi (sidumiskoha) ilmnemise, nagu näites kolisema:
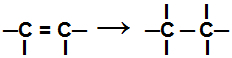
Pi-sideme purustamine alkeenis
Pärast selle sideme purunemist peab orgaanilistesse ühenditesse loodud uutesse sidumiskohtadesse lisama aatomeid. Allpool loetleme nende tüübid liitumisreaktsioonid mida saab läbi viia orgaaniliste ühenditega.
hüdrogeenimine
Selles liitmisreaktsioonlisaks orgaanilisele ühendile on teiseks reagendiks gaasiline vesinik (H
2). Igas süsinikus, kus toimub lõhustumine (sigma või pi sideme purunemine, nagu varem näha), on vesinikuaatomi side, mis viitab purustatud sidemete hulgale.Näiteks tsüklobutaani hüdrogeenimisel katkeb süsinik 1 ja 2 vahel sigmaside. Siis seondub vesinikuaatom kõigi nende süsinikega:
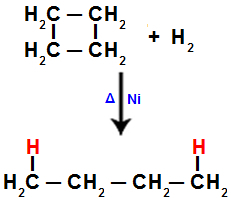
Hüdrogeenimist võrrand tsüklobutaanis
Halogeenimine
Lisaks orgaanilisele ühendile ka teine reagent selles liitmisreaktsioon on molekulaarne halogeen (kloor-Cl gaas2, fluor-F gaas2, tahke jood-I2 ja vedel broom-Br2). Igal süsinikul, kus toimub lõhustumine (sigma- või pi-sideme purustamine, nagu eespool näha), on halogeen viidates katkiste ühenduste arvule.
Seega, kui teostame tsüklopropeeni halogeenimise (kasutades kloorgaasi), on pi-side süsinike 1 ja 2 vahel katki. Seejärel seondub kloori aatom kõigi nende süsinikega:

Halogeenimist tsüklopropeenis esitav võrrand
Ärge lõpetage kohe... Peale reklaami on veel;)
Lisamisreaktsioon halhüdriididega
Halogeniid on anorgaaniline hüdrohape, mille moodustavad vesiniku aatom ja vesiniku aatom. halogeen, näiteks vesinikkloriidhape (HCl), vesinikfluoriidhape (HF), vesinikbromiidhape (HBr), hape hüdroiodiood (HI).
Kell liitmisreaktsioon halogeniidiga on lisaks orgaanilisele ühendile teine reagent halogeniid, seega üks süsinikuaatomitest, kus lõikamine (sigma- või pi-sideme purunemine, nagu eespool näha) peab saama vesiniku aatomi ja teine halogeniid.
Vastavalt Markovnikovi reegel, peab hüdrogeenitud süsinikuaatom (või väiksema radikaali külge kinnitatud süsinik) saama vesinik ja vähem hüdrogeenitud süsinik (või suurema radikaali külge kinnitatud süsinik) peab saama halogeniid.
Näiteks kui teeme selle reaktsiooni propeenil vesinikkloriidhappega (HCl), siis pi-side on süsinike 1 ja 2 vahel katki. Seejärel seondub vesinik süsinik 1 (rohkem hüdrogeenitud) ja kloor süsinik 2 (vähem hüdrogeenitud):
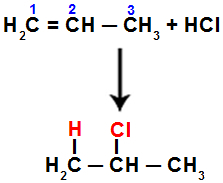
Propeenis sisalduva halogeniidiga liitmise võrrand
Hüdratsioonireaktsioon
Ioniseerides tekitab veemolekul hüdrooniumkatiooni (H+) ja hüdroksiidanioon (OH-). Sel põhjusel selles liitmisreaktsioon, lisaks orgaanilisele ühendile on teiseks reagendiks vesi. Seega saab üks süsinik, kus toimub lõhustumine (sigma- või pi-sideme purunemine, nagu eespool näha), hüdrooniumkatiooni ja teine hüdroksiidaniooni.
Markovnikovi reegli kohaselt on kõige hüdrogeenitud süsinikuaatom (või väiksema radikaali külge kinnitatud süsinik) peab saama hüdrooniumit ja vähem hüdrogeenitud süsinik (või suurema radikaali külge kinnitatud süsinik) peab saama hüdroksiid.
Näiteks hüdraatides penta-1,4-dieeni, puruneb pi-side süsinike 1 ja 2 ning süsinike 4 ja 5 vahel. Seejärel saavad süsinikud 1 ja 5 hüdrooniumi ning süsinikud 2 ja 4 hüdroksiidi:
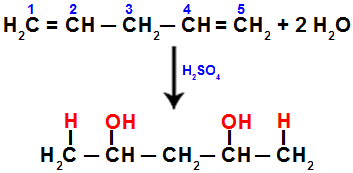
Võrrand, mis tähistab hüdratsiooniga liitmist penta-1,4-dieenis
Minu poolt. Diogo Lopes Dias

