Lämmastikühend on orgaaniline ühend, mis saadakse lämmastikhappe (HNO3) see on alkaan (avatud ahelaga küllastunud süsivesinik) või aromaatne. Kui lämmastikhape reageerib alkaaniga või aromaatne, toimub asendusreaktsioon, milles hape kaotab hüdroksüülrühma (OH) ja orgaaniline ühend kaotab vesiniku:
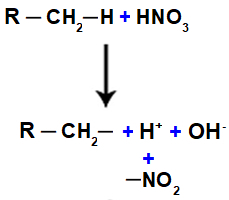
Järgmisena on meil vesimolekul, mis tuleneb OH ja H liitumisest, samas kui EI gruppi2 (mis jääb happest üle) seondub alkaaniga või aromaatne, moodustades nitroühend.
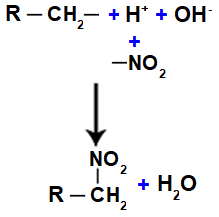
Vee ja lämmastikühendi moodustumise kujutamine
Seega on a nitroühend on ühe või mitme olemasolu nitrogrupid (JUURES2) seotud alkaani või aromaatsega.
omadused
Austusega omadused füüsiline, võime esile tõsta:
Üldiselt on need toatemperatuuril viskoossed vedelikud (välja arvatud nitroühendid madala molaarmassiga, mis on vedelad vedelikud);
Neil on kõrged sulamis- ja keemistemperatuurid;
Need on tihedamad kui vesi;
Üldiselt on need vees lahustumatud, välja arvatud nitrometaan ja nitroetaan;
Alifaatse ahela moodustamisel on neil meeldiv aroom ja nad pole mürgised. Nüüd, kui need on moodustatud aromaatsest ahelast, on need mürgised ja ebameeldiva aroomiga;
O molekulidevahelise jõu tüüp mis ühendab oma molekule on püsiv dipool, kuna neil on polaarsed omadused.
Keemiliste omaduste osas peame teadma, et nitroühendid need on väga reaktiivsed, st neid kasutatakse erinevates orgaanilistes reaktsioonides, näiteks asendusreaktsioonides.
Ametlik nomenklatuuri reegel, mille esitas IUPAC (Rahvusvaheline puhta ja rakendusliku keemia liit) nitroühendid é:
Ärge lõpetage kohe... Peale reklaami on veel;)
Nitro + eesliide + järelsõna + o
Märge: Eesliide on seotud nitroühendi ahelas olevate süsinike arvuga. Infiks on seotud süsinike vahel esinevate sidemete tüübiga.
Näited:
Normaalse ahelaga nitroühendi nomenklatuur

Esialgu on huvitav nummerdada string nitroühend (alati süsinikust, mis on kõige lähemal süsinikule, millel on nitrogrupp)
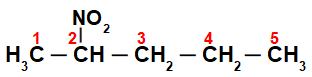
Numbri stringiga nitroühend, on meil selles, et selles on viis süsinikuaatomit (eesliide pent), süsinik 2 (süsinik an 2) ja nitrogrupi vahel on üksikud sidemed. Selle struktuuri nimi on 2-nitropentaan.
Normaalse ahelaga nitroühendi nomenklatuur
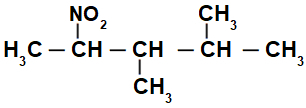
Hargnenud nitroühendi struktuurivalem
Esialgu on huvitav nummerdada string nitroühend (alati süsinikust, mis on kõige lähemal süsinikule, milles on nitrogrupp), minnes lõpuni, kus on peaahela jaoks kõige rohkem süsinikke:
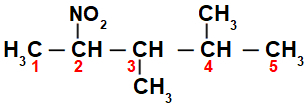
Numbri stringiga nitroühend, meil on selles 5 süsinikuaatomit (eesliide pent), ainult üksiksidemed süsinike (infix an), kahe metüülradikaali (süsinikuarvudel 3 ja 4) ja nitrogrupi vahel süsinikul 2. Selle struktuuri nimi on 3,4-dimetüül-2-nitropentaan.
Kasutab
Sina nitroühendid, üldiselt saab neid kasutada pestitsiidide, värvainete, aniliini, bakteritsiidide, fungitsiidide, lisandite, lahustite valmistamiseks; need toimivad ka lõhkeainetena ja nafta rafineerimisel.
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Mis on lämmastikühend?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-nitrocomposto.htm. Juurdepääs 28. juunil 2021.


