geomeetriline isomeer on omamoodi kosmoseisomeeria mis hindab ja võrdleb ahelas oleva kahe süsiniku aatomi ligandide positsiooni ruumis. See hinnang tehakse kaasatud süsinike vahelisest mõttelisest tasapinnast.
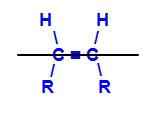
Molekuli jagav kujuteldav tasapind
Kujuteldav tasapind ülaltoodud struktuuris jagab molekuli ülemiseks ja alumiseks tasandiks. Selle abil saame hinnata ja võrrelda nendes tasapindades osalevaid süsiniku ligandeid. Vaadake geomeetriliste isomeeride tüüpe:
→ Cis-trans geomeetriline isomeer
Ühendil on cis-trans geomeetriline isomeeria kui kett kuvab:
Kahe sidemega avatud ahel kahe süsiniku vahel, millel on omavahel samad linkerid. Vaadake näidet:
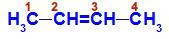
But-2-eeni struktuurivalem
Struktuuris võime täheldada, et nii süsinikul 2 kui ka süsinikul 3 on samad ligandid, milleks on vesinik (H) ja metüül (CH3).
Suletud ahel kahe süsinikuga, millel on üksteisega samad ligandid. Vaadake näidet:
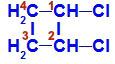
1,2-dikloro-tsüklobutaani struktuurivalem
Struktuuris võime täheldada, et nii süsinikul 1 kui ka süsinikul 2 on samad ligandid, milleks on vesinik (H) ja kloor (Cl).
Cis-trans-isomeeria selgitamiseks kasutame but-2-eeni:
a) cis-isomeer: on geomeetriline isomeer, milles samad ligandid hõivavad sama tasapinna. Allpool toodud näites on vesinikud samal tasapinnal, nagu ka metüülradikaalid.

Cis-but-2-eeni struktuurivalem
b) trans-isomeer: on geomeetriline isomeer, milles erinevad ligandid hõivavad sama tasandi. Allpool toodud näites on meil samal tasapinnal vesinik ja metüül (CH3).
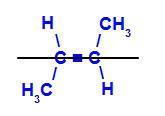
Trans-but-2-eeni struktuurivalem
Ärge lõpetage kohe... Peale reklaami on veel;)
→ E-Z geomeetriline isomeer
Ühendil on E-Z geomeetriline isomeeria, kui kettil on:
Kahe sidemega avatud ahel kahe süsiniku vahel, millel on kõik või mõned erinevad linkerid. Vaadake näidet:
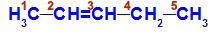
Pent-2-eeni struktuurivalem
Struktuuris näeme, et süsinikul 2 on metüülligand (CH3) ja vesinik (H) ning süsinikul 3 on vesiniku (H) ja etüül (H) ligand3C-CH2).
Suletud ahel kahe süsinikuga, millel on kõik või mõned erinevad ligandid. Vaadake näidet:
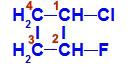
1-kloro-2-fluoro-tsüklobutaani struktuurivalem
Struktuuris võime täheldada, et süsinikul 1 on peamised ligandid vesinik ja kloor ning süsinikul 2 on peamised ligandid vesinik ja fluor.
MÄRGE: Erinevate ligandide seas hindame geomeetrilises isomeerias ligandi keerukust (aatomite arvu) või aatomite arvu.
E-Z isomeeri selgitamiseks kasutame nii pent-2-eeni kui ka 1-kloro-2-fluoro-tsüklobutaani:
a) E-isomeer
geomeetriline isomeer milles keerukamad või suurima aatomnumbriga ligandid paiknevad vastandtasanditel. Järgmises näites on süsiniku 2 kõige keerukam ligand metüül ja süsiniku 3 kõige keerulisem ligand etüül, mis paiknevad erinevatel tasapindadel.
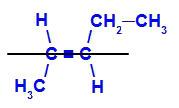
E-pent-2-eeni struktuurivalem
b) isomeer Z
geomeetriline isomeer kus keerukamad või kõrgeima aatomnumbriga ligandid asuvad samal tasapinnal. Järgmises näites on süsiniku 1 kõrgeim aatomnumbriligand kloor (Z = 17) ja süsiniku 2 suurim aatomnumbriligand on fluor (Z = 9), mis paiknevad samas tasapinnas.
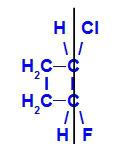
Z-1-kloro-2-fluoro-tsüklobutaani struktuurivalem
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Mis on geomeetriline isomeeria?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-geometrica.htm. Juurdepääs 28. juunil 2021.
Keemia
Tea, mida kujutavad endast erinevat tüüpi tasapinnalised ja ruumilised isomeerid, näiteks funktsioon, asend, ahel, tautomeeria, metamerism, cis-trans geomeetriline ja optiline isomeerika.

