Hüdrogeenimine toimub küllastumata atsükliliste süsivesinikega, see tähendab, et neil on avatud ahelad topelt- või kolmiksidemetega nagu alkeenid, alküünid ja dieenid. See võib esineda ka aromaatsetes süsivesinikes, kuna neil on tsüklis kaksiksidemed ja kuni viie süsinikuga tsüklaanide (tsükloalkaanide) korral.
Need ühendid reageerivad gaasilise vesinikuna mõne katalüsaatori nagu nikli, plaatina ja pallaadium juuresolekul kuumutamisel. Seega toimub liitumisreaktsioon, kus pi (π) side on katki, moodustades kaks uut üksiksidet ja molekuli sisestatakse vesinik.
Üldiselt on meil:
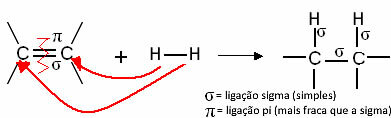
Üldine hüdrogeenimisreaktsioon
Vaatame nüüd mõningaid näiteid:
- Hüdrogeenimine alkeenideksSaadud toode on alkaan.
Allpool on etüaani (või etüleeni) hüdrogeenimisreaktsioon etaani saamiseks:
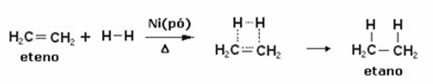
Näide etüleeni hüdrogeenimisreaktsioonist
Seda tüüpi katalüütilist hüdrogeenimist kasutab toiduainetööstus selliste pooltahkete rasvade valmistamiseks nagu margariinid. Taimeõlid ja -rasvad erinevad ainult selle poolest, et õlidel on pikad molekulid kaksiksidemetega süsinike vahel, samas kui rasvade vahel on ainult üksiksidemed süsinikud.
Seega piisab õli rasvaks muutmiseks õli hüdrogeenimisest. Nii teie kaksiksidemed purunevad ja muudetakse üksikvõlakirjadeks. Tulemuseks on kõnede tootmine hüdrogeenitud taimsed rasvad.
- Alküüni hüdrogeenimine: Kuna alküünidel on kaks pi-sidet, toimub nende täielik hüdrogeenimine kahes etapis, esimeses moodustub alkeen ja teises alkaan.
Allpool toodud reaktsioonis hüdrogeenitakse propüüni lõpliku propaani moodustumisega:
1. samm: H3C C ≡ CH + H2 → H3C CH═ ÇH2
2. etapp: H3C CH═ ÇH2 + 2 tundi2 → H3C CH2─ ÇH3
Kui tahame, et see reaktsioon peatuks 1. etapis, peame kasutama mõnda ainet, mis peatab katalüsaatori tegevuse.
- Dieenide hüdrogeenimine: Dieene on kolme tüüpi: kogunenud (kaksiksidemed ilmuvad allpool), isoleeritud (kaksiksidemed on eraldatud vähemalt kahe üksiksidemega) ja konjugaadid (kaksiksidemed ilmuvad vaheldumisi).
Kogunenud ja eraldatud dieenide hüdrogeenimine toimub samamoodi, nagu nägime alkeenide puhul, kuid kahekordseks, kuna dieenidel on rohkem küllastumata. Vaadake kahte näidet:
* Hüdrogeenimise näide akumuleeritud dieenis:
H H H
│ │ │
H3C CH ═ Ç ═ CH ─ CH3 + 2 tundi2 → H3C CH ─ Ç ─ CH ─ CH3
│ │ │
H H H
* Näide hüdrogeenimisest isoleeritud dieenis:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 ─ CH ═ CH ─ CH3 +2 H2 → H3C CH ─ CH─CH2 ─ CH ─ CH ─ CH3
Teisalt võib konjugeeritud dieenide hüdrogeenimine toimuda kahel viisil: 1,2 liitmise ja 1,4 liitmisega. Kõige tavalisem on 1,2 liitmine, milles süsinikele, mis moodustavad kaksiksideme, lisatakse madalatel temperatuuridel vesinikke. 1,4 liitmine toimub seevastu kõrgendatud temperatuuridel ja see on siis, kui süsinikutes 1 ja 4 on resonants ja vabade valentside ilmnemine. Vaadake iga juhtumi näiteid:
* Näide 1,2 lisamisest konjugeeritud dieenides:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH CH2
│ │
H H
* Lisamise 1.4 näide konjugeeritud dieenides:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Aromaatide hüdrogeenimine: Benseenitsükli pi-sidemed on katki ja vesinikuaatomid lisatakse neid sidemeid moodustavatele süsinikele.
Seda tüüpi hüdrogeenimist on näidatud allpool:

Kogu benseeni hüdrogeenimisreaktsioon
- Tsüklaani hüdrogeenimine: Tekib alkaan.
Näide: tsüklopropaani hüdrogeenimine:
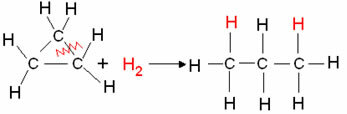
Tsüklopropaani hüdrogeenimisreaktsioon
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm

