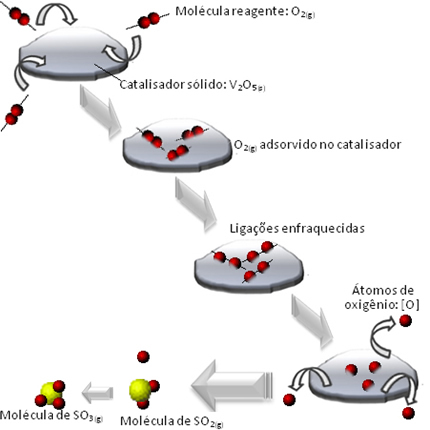
Suhteline tihedus (δ) antakse kahe gaasi absoluutse tiheduse jagatis samades temperatuuri ja rõhu tingimustes.
Oletame, et meil on gaas 1 ja gaas 2, seega on suhteline tihedus järgmine:
δ12 = d1
d2
Pange tähele, et suhtelisel tihedusel pole ühtsust, kuna see on puhas arv, mis näitab ainult seda, mitu korda on üks gaas rohkem või vähem tihe kui teine. Kuna see on lihtsalt puhas arv, siis temperatuuri ja rõhu kõikumine seda ei mõjuta. Siiski on oluline, et need kaks kogust oleksid mõlemal gaasil ühesugused.
Meil on see tihedus gaasi hõivatud massi ja mahu suhe (d = m / V). Niisiis, saame selle seose asendada ülaltoodud valemiga:
δ12 = d1
d2
δ12 = m1/ V1
m2/ V2
CNTP-s (normaalsed temperatuuri- ja rõhutingimused) hõivab iga gaas mahu 22,4 L. Nii et sel juhul on V1 = V2, mida saab ülaltoodud valemis tühistada.
δ12 = m1
m2
Suhteline tihedus on proportsionaalne gaaside massidega.
Vaatame näidet suhtelise tiheduse määramiseks:
Näide: Millised on kahe gaasi A ja B suhtelised tihedused, teades, et:
Gaas A: m = 33g ja V = 11 L;
Gaas B: m = 24,2 g ja V = 12,1 L.
Resolutsioon:
dTHE = m = 33g = 3 g / l
V 11L
dB = m = 24,2 g = 2 g / l
V 12,1L
δAB = dTHE
dB
δAB = 3 g / l
2 g / l
δAB = 1,5
Suhtelise tiheduse saame seostada ka gaasi oleku võrrandiga (PV = nRT), nagu tekstis selgitatud Absoluutne gaasitihedus, Me peame:
d = PM
RT
Siis:
d1 = PM1
RT
d2 = PM2
RT
d1= PM1/RT
d2 PM2/RT
d1 = M1
d2B M2
Ärge lõpetage kohe... Pärast reklaami on veel rohkem;)
Pange tähele, et suhteline tihedus on proportsionaalne gaaside molaarmassidega, see tähendab, et mida suurem on gaasi molaarmass, seda suurem on selle tihedus. Näiteks on õhu molaarmass 28,96 g / mol, heeliumgaasil on 4 g / mol ja süsinikdioksiidil 44 g / mol.
See tähendab, et heeliumgaasi tihedus õhu suhtes on väiksem. Sellepärast, kui täidate õhupalli heeliumgaasiga ja lasete sellel lahti, kipub see tõusma. Teisest küljest on süsinikdioksiid õhust tihedam, nii et kui täidame õhupalli kopsude „õhuga”, täidame õhupalli tegelikult süsinikdioksiidiga. Sel viisil, kui laseme õhupalli õhku, siis kipub see kukkuma.

Kui õhku lastakse õhupall, mis sisaldab gaasi molaarmassiga alla 28,96 g / mol, tõuseb see õhku; aga kui see on suurem, siis see langeb
Arvestades õhku (mis on gaaside segu) võrdlusena, võime öelda, et mis tahes gaasi suhtelise tiheduse selle suhtes saab anda valemiga:
δõhk = _M_
28,9
M = 28,9. δTher
Kui võrdlusgaas on teine, asendage lihtsalt nende vastavad väärtused. Näiteks vesinikgaasi korral on selle molaarmass 2 g / mol, seega on meil:
δH2 = _M_
2
M = 2. δ H2
* Toimetuse krediit: Keith Bell / Shutterstock.com
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Gaaside suhteline tihedus"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/densidade-relativa-dos-gases.htm. Juurdepääs 27. juunil 2021.
Mis on gaasid, millised on gaaside omadused, molekulaarsed ühendid, kokkusurutavus, fikseeritud maht, kineetiline energia keskmine, absoluutne gaasi temperatuur, ideaalne gaas, reaalsed gaasid, täiuslik gaas, gaasi oleku muutujad, gaasi maht, aastaajad