juhtub muutumineisohoorne kui gaasi etteantud mass läbib muutusi temperatuur mis käivitavad rõhumuutused või vastupidi, arvestades seda temperatuuri ja surveon antud juhul otseselt proportsionaalsed kogused, samas kui süsteemi maht jääb muutumatuks.
Vaadake ka: Mis on gaaside osaline rõhk?
Mis on isohoorne muundumine?
Isokoorne muundumine on siis, kui temperatuuri ja rõhu muutus toimub antud gaasimassiga, kuid selle maht jääb samaks. Rõhumuutus on otseselt proportsionaalne temperatuurigasee tähendab, et kui gaas kahekordistab teatud suletud süsteemis absoluutset temperatuuri, põhjustab see rõhu tõusu kahekordseks, kui see oli algselt.
Seda tüüpi teisendusi nimetatakse ka isovolumetriline või isomeetriline. Isohoorne termin pärineb kreeka keelest Isokhora, mille kohta iso tähendab "võrdne" ja khora tähendab "koht või maht" (selles kontekstis).
Näited:
Auto rehvid läbivad isokoorse muundumise, seda tehes võime seda jälgida kalibreerimine. Kuumadel päevadel on kalibreerimismonitorile antud rõhk suurem kui külmadel päevadel. Seda seetõttu, et temperatuuri tõustes rõhk suureneb, kuna maht jääb püsima.

Teised näited on pihustatavad deodorandid, seda tüüpi toodete puhul on sildil hoiatus, et neid ei tohi hoida ega allutada kõrgetele temperatuuridele, sest lisaks sellele, et mõned selle ained on tuleohtlikud, on tingimus isohoorne muundumine või isovolumetriline. Kuna aerosooldeodorandid on suletud pudelis ja gaasilises olekus, on temperatuuri tõus toob kaasa rõhu tõusu ja plahvatuse ohu.
Ärge lõpetage kohe... Peale reklaami on veel;)
Isokoorse muundumise tunnused
- püsiv helitugevus.
- Rõhk ja temperatuur on otseselt proportsionaalsed.
Neid omadusi saab kirjeldada järgmiste valemitega:

Isokoorse funktsiooni graafik
Pange tähele järgmist tabelit, mis kirjeldab gaasi käitumist rõhu, temperatuuri ja sellest tuleneva konstandi suhtes.
Temperatuur (° C) |
Rõhk (atm) |
P / T = konstant |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Pange tähele, et rõhk järgneb temperatuuri tõusule, nii et P / T suhe jääb konstantseks, see tähendab, et rõhk ja temperatuur on otseselt proportsionaalsed suurused. Seetõttu on isokoorseid teisendusi kirjeldav graafik lineaarset tüüpi. Vaata:

Kes avastas isohoorse muundumise?
Jacques Alexandre César Charles (1746-1823) oli prantsuse teadlane, kes täppistermomeetri loomiseks suletud süsteemis gaaside käitumist uurides lõpetas isokooriliste muundumiste uuringud.
Teadlane Joseph Louis Gay-Lussac (1778-1850) töötas välja ka uuringu gaasilise süsteemi laienemise ja kahanemise kohta. Need olid sõltumatud analüüsid, kuid kuna nad jõudsid samale järeldusele, jagasid nad ainepunktid. Täna viitavad mõned autorid kahele viimasele gaaside füüsikalisele seadusele, mis seda selgitavad isobaarsed teisendused ja isohoorsed Charles-Gay-Lussaci 1. ja 2. seadus.
Vaadake ka: Gay-Lussaci mahuseadus
Harjutusedlahendatud
Küsimus 1 - (PUC-RJ) Jalgratta rehv kalibreeritakse külmal päeval rõhul 4 atm, temperatuuril 7 ° C. Sissepritsitud gaasi maht ja kogus on ühesugused. Milline on rehvi kalibreerimisrõhk, kui temperatuur saavutab 37 ° C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Resolutsioon
Alternatiiv A
1. samm: tuvastage süsteem ja eraldage andmed.
Isovolumetriline süsteem
P1 = 4 atm
T1 = 7 ° C
T2 = 37 ° C
P2 =?
Kasutades valemit:
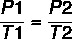
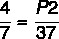
7 x P2 = 37 x 4
P2 = 148/7
P2 = 21,14 atm
2. küsimus - (Unifor-CE) Uurige allolevat joonist.
Gaasi rõhku süstlas saab vähendada:
a) süstla asetamine jäävette, hoides otsa sulgurit.
b) kolbi pigistamine, hoides otsa kinni.
c) asetades süstal kuumas vees, hoides selle otsa kinni.
d) otsa avamine ja pool õhust süstlast välja laskmine.
e) kolvi tõmbamine, hoides otsa lahti.
Resolutsioon
Alternatiiv A. Gaasi rõhk on otseselt proportsionaalne temperatuuriga isokoorses süsteemis, see tähendab ilma gaasi mahtu või massi muutmata. Temperatuuri languse korral langeb ka rõhk.
Autor Laysa Bernardes Marques de Araujo
Keemiaõpetaja
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
ARAúJO, Laysa Bernardes Marques de. "Isohoorne (isovolumetriline) muundamine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm. Juurdepääs 27. juunil 2021.