Isobaarne muundumine toimub siis, kui gaas on püsiva rõhu all. Näiteks kui see toimub avatud keskkonnas, on muundumine isobaarne, kuna rõhk on atmosfäärirõhk, mis ei muutu.
Sellisel juhul on temperatuur ja maht erinevad. Kaks juhtivat teadlast on uurinud, kuidas see variatsioon isobaarsetes transformatsioonides toimub. Esimesena seostas gaaside mahtu ja temperatuuri Jacques Charles (1746–1823) 1787. aastal ning seejärel, 1802. aastal, kvantifitseeris Joseph Gay-Lussac (1778–1850) selle seose.
Nii tekkis seadus, mis seletab gaaside isobaarseid muundumisi, mis sai nimeks Charles / Gay-Lussaci seadus. See on öeldud järgmiselt:
"Konstantse rõhuga süsteemis on gaasi kindla massi maht otseselt proportsionaalne temperatuuriga."

See tähendab, et kui me kahekordistame temperatuuri, kahekordistub ka gaasi hõivatud maht. Teisest küljest, kui me temperatuuri langetame, väheneb samas proportsioonis ka gaasi maht.
Seda on näha väga lihtsas katses. Kui asetame õhupalli pudeli kaela, jääb kinni kindel õhumass. Kui kastame selle pudeli jääveekaussi, siis õhupall tühjeneb. Kui me paneme selle kaussi kuuma veega, täidetakse õhupall.
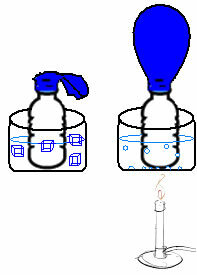
Seda seetõttu, et temperatuuri tõustes suureneb gaasimolekulide kineetiline energia ja suureneb ka nende liikumiskiirus. Seega gaas paisub, suurendades selle hõivatud mahtu ja õhupall paisub. Vastupidine juhtub siis, kui alandame temperatuuri, pannes selle külma vette.
Ärge lõpetage kohe... Peale reklaami on veel;)
See seos temperatuuri ja mahu vahel isobaarsetes muundumistes annab järgmise seose:
V = k
T
"k" on konstant, nagu on näha järgmiselt graafikult:
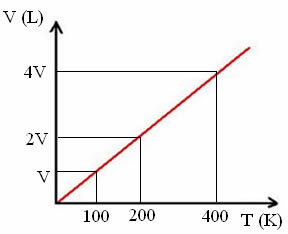
Pange tähele, et V / T suhe annab alati konstandi:
_V_ =_2V_ = _4V_
100 200 400
Seega saame isobaarsete teisenduste jaoks luua järgmise seose:
Vinitsiaalne = VLõplik
Tinitsiaalne TLõplik
See tähendab, et kui püsiva rõhu all toimub gaasi temperatuuri muutus, võime selle matemaatilise avaldise abil leida selle mahu. Samuti on vastupidi, teades gaasi mahtu, saame teada, mis temperatuuril see on. Vaadake näidet:
"Gaasiline mass võtab mahuks 800 cm3 temperatuuril -23 ° C, antud rõhul. Milline on temperatuur, mis registreeritakse, kui gaasiline mass hõivab sama rõhu korral mahtu 1,6 L? "
Resolutsioon:
Andmed:
Vinitsiaalne = 800 cm3
Tinitsiaalne = -23 ºC, liites 273 on 250 K (Kelvin)
VLõplik = 1,6 l
TLõplik = ?
* Kõigepealt peame jätma helitugevuse samasse seadmesse. On teada, et 1 dm3 võrdub 1 liitriga. nagu 1 dm3 on sama mis 1000 cm3, näib, et 1 liiter = 1 000 cm3:
1 L 1000 cm3
x 800 cm3
x = 0,8 L
* Nüüd asendame valemi väärtused ja leiame lõpliku temperatuuri väärtuse:
Vinitsiaalne = VLõplik
Tinitsiaalne TLõplik
0,8_ = 1,6
250 tLõplik
0,8 TLõplik = 250. 1,6
TLõplik = 400
0,8
TLõplik = 500K
* Liikudes Celsiuse skaalale, on meil:
T (K) = T (° C) + 273
500 = T (° C) + 273
T (° C) = 500 - 273
T (° C) = 227 ° C
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Isobaarne muundumine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. Juurdepääs 27. juunil 2021.
Mis on gaasid, millised on gaaside omadused, molekulaarsed ühendid, kokkusurutavus, fikseeritud maht, kineetiline energia keskmine, absoluutne gaasi temperatuur, ideaalne gaas, reaalsed gaasid, täiuslik gaas, gaasi oleku muutujad, gaasi maht, aastaajad
Keemia

Gay-Lussaci seadused, Prousti seadus, keemiline reaktsioon, pidev osakaal, ainemassid, puhas aine, analüüs kvalitatiivne ja kvantitatiivne, täiuslike gaaside seadus, konstantsete proportsioonide seadus, kindlate proportsioonide seadus, seadus mahuline.