THE ionisatsioonikonstant annab Vesi(Kw), O vesiniku potentsiaal(pH) see on hüdroksüliooniline potentsiaal (pOH) nemad on meetmed oluline arvutuste jaoks keemiline tasakaal happelistes ja aluselistes lahustes, samuti H-ioonide kontsentratsiooni määramisel+ ja oh- kõnealustest lahendustest.
Mis on Kw?
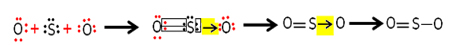
Vee ioonsaadus ehk Kw (see wtähendab vesi - vesi, inglise keeles) on konstant, mida kasutatakse vee eneseioniseerimisel tekkiv tasakaal. Isegi väga väikese kiirusega ioniseerib vesi H-ioone+ ja oh-, vastavalt järgmisele keemilisele võrrandile:

Võrrandit analüüsides mõistame, et kui ionisatsioon puhta vee molekulist tekib H ioon.+ ja OH-ioon-see tähendab nende ioonide kontsentratsioon on alati sama. Isegi temperatuuri tõusu korral, mis põhjustab ionisatsioonikiiruse kasvu, jäävad kontsentratsioonid samaks.
Loe ka:Ionisatsioonienergia
Katsemõõtmiste põhjal arvutati H ioonide kontsentratsioon+ ja oh- (mis tuleneb vee eneseionisatsioonist) temperatuuril 25 ° C ja 1. 10-7 mol / l
. See on, kokku 1 miljardist veemolekulist, ainult kaks läbivad ionisatsiooni. See näitab, et puhta veega on madal ioniseerimisaste ja see seletab väga madalat Elektrijuhtivus puhast vett.Arvestades ülaltoodut, võime kirjutada väljendus veetasakaalu konstandist:

H-iooni kontsentratsiooni väärtuste kasutamine+ ja oh- temperatuuril 25 ° C saame arvutada K väärtusew:

Nagu varem öeldud, on see väärtus Kw muutub temperatuuri tõustes, nagu on näidatud allolevas tabelis:
T (° C) |
Kw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
Selle teema kohta lisateabe saamiseks lugege meie teksti: Iooniline veetoode.
Mis on pH ja pOH?

lühend pH tähendab vesiniku potentsiaal ja selle lõi Taani biokeemik Soren Sorensen, 1909. aastal, et hõlbustada tööga vesinikioonide kontsentratsioonid [H+], mis on tavaliselt väljendatud kümnendarvuna. Selle teema kohta lisateabe saamiseks lugege meie teksti: Mis on pH?
Selline märkimine tähistab H ioonide sisaldust+ lahuses ja on määratletud matemaatilise avaldisega:

Samamoodi võime määratleda pOH või hüdroksüülioonne potentsiaal, mis ütleb meile OH ioonide sisaldus- lahuses. Selle matemaatiline väljend on:

Vesilahuses on alati H ioone+ ja oh- (vee poolt kantud ionisatsiooni tõttu), mida kasutatakse lahuse iseloomustamiseks happeline või põhiline. Mida rohkem H ioone+ lahuses on, seda happelisem see on. Järelikult OH-ioonide olemasolu- lahenduses muudab selle põhilisemaks. Kui nende ioonide kogus on tasakaalus, klassifitseeritakse lahus neutraalne.
pH skaala
PH-skaala kuvatakse väärtustega vahemikus 0 kuni 14 (väärtused mõõdetakse temperatuuril 25 ° C). Vaadake pH-skaalat alloleval pildil:

Mida madalam on pHlahusest,suurem on selle happesus, ja mida lähemal skaala lõpule, st lähemale 14-le, seda suurem on selle põhitegelane. Näiteks sidrunimahla pH on 2, valgendajate pH on 12.
Kuidas arvutada pH ja pOH
teades ioonide kontsentratsioon, me saame arvutage väärtused lahuse pH ja pOH ning teades potentsiaalseid väärtusi, arvutame ioonide kontsentratsioon lahustes. Sel eesmärgil kasutatakse järgmisi väljendeid:

Läheme näidete juurde:
Näide 1
Kui tahame teada lahuse pH väärtusega [H+] = 0,001 mol / L, kasutage lihtsalt eelnevalt esitatud valemit:

Näide 2
Nüüd, et teada saada, milline on OH kontsentratsioon- pOH = 5 lahuse asendage väärtus lihtsalt järgmises valemis:

Kui rakendame vee ioonbilansile sama potentsiaalide skaalat, on meil:

Nagu öeldud, temperatuuril 25 ° C oli Kw = 10-14. Seetõttu:

Selle abil saame lahuse pOH arvutada selle pH põhjal. Kui meil on lahus, mille pH on 3, on selle pOH 11.
Tea rohkem: Neutraalsed, happelised ja aluselised keskkonnad
lahendatud harjutused
1. küsimus (UEFS-BA) OH ioonide kontsentratsioon–(siin) antud ammooniumhüdroksiidi lahuses on temperatuuril 25 ° C 1,10–3 mol / l. Selle lahuse pOH on:
a) 0
b) 1
c) 3
d) 11
e) 13
Resolutsioon: Täht C. Kui meil on [OH–] = 10–3 mol / l, seega on teie pOH võrdne 3-ga.
Vaata:

Küsimus 2 (UEA-AM) Vaatleme järgmist teavet, mis on saadud Porto Seguro (BA) linnas asuva mineraalvee sildilt:
nitraat 1,45 mg / l
pH temperatuuril 25 ° C 4,51
See mineraalvesi on
a) happeline ja sellel on [H+] –].
b) happeline ja omab [H+]> [OH–].
c) neutraalne ja sellel on [H+] = [OH–].
d) põhiline ja sellel on [H+]> [OH–].
e) põhiline ja sellel on [H+] –].
Resolutsioon: Täht B. Kuna sildil märgitud mineraalvee pH on väiksem kui 7, võime öelda, et see on happeline lahus ja seetõttu H-ioonide kontsentratsioon+ on suurem kui OH omad-.
3. küsimus (UEA-AM) Üks viis gaasilise vesiniku kiireks tootmiseks laboris on pulbrilise metalltsingi reageerimine vesinikkloriidhappega (HCl) kontsentratsioonis 1,0 mol / L:
Zn (s) + 2 HCl (vesilahus) → ZnCl2 (aq) + H2 g)
Arvestades, et vesinikkloriidhape on 100% ioniseeritud ja lahuse temperatuur on 25 ° C, on õige väita, et tekstis nimetatud vesinikkloriidhappe lahuse pH on
- 0
- 1
- 3
- 13
- 14
Resolutsioon:Täht a. Lahuse pH saab arvutada tekstis toodud HCl kontsentratsiooni abil, kuna kuna see on 100% ioniseeritud, [H+] on sama, sest iga ioniseeritud HCl molekuli jaoks on üks H ioon+ luuakse. Seetõttu:

Autor Victor Ferreira
Keemiaõpetaja