difusioon ja efusioon on kaks Šoti keemiku Thomas Grahami poolt 19. sajandil välja pakutud seadust, mis põhinevad tema uuringutel gaasisegud ja käitumine gaasid konteineri seintest läbi minnes.
Thomas Grahami tähelepanekute hulgas gaaside käitumise kohta seoses difusiooni ja efusiooniga võime välja tuua järgmise:
Gaasil on alati kalduvus läbi tahkes olekus leiduvate väikeste aukude;
Mida suurem on molekuli mass gaas, seda suurem on selle raskus tahke aine aukude läbimisel;
Mida väiksem on gaasi tihedus, seda suurem on selle liikumiskiirus;
Mida kõrgem on gaasi temperatuur, seda suurem on kiirus, mille kaudu see levib keskkonda või läbib ava;
- Gaas ei püsi kunagi kindlas kohas staatilisena.
Difusioon
Difusioon see on füüsikaline nähtus, mis seisneb gaasi võimes hajuda (see tähendab levida) kogu ala ruumis või konteineri sees. Sel põhjusel võime öelda, et ruumis ei piirdu gaas kunagi ühes kohas.

Saate esinemise kujutamine
Lisaks saame määratleda difusioon endiselt kui mahutavus, mida üks gaas peab samasse anumasse asetatuna teisega segama, moodustades homogeense gaasilise segu.
Näide on see, kui sõiduki heitgaasidest väljuvad gaasid. Nii mürgised kui nad ka pole, ei kahjusta need lühiajaliselt inimesi, kuna need levivad kogu atmosfääriõhus, vähendades järelikult nende kontsentratsiooni.
Efusioon
Efusioon see on füüsikaline nähtus, mis seisneb gaasi läbimises läbi teatud konteineri seintes olevate aukude, see tähendab gaasi väljumist ühest keskkonnast teise.

Väljavalamise esinemise kujutamine
Näide on see, kui õhupallid on pidu jaoks puhutud ja järgmisel päeval tühjendatakse need kõik õhupallides sisalduvate aukude kaudu väljuva õhu tõttu.
Difusiooni ja efusiooniga seotud arvutused
Grahami pakutud võrrandite järgi saame arvutada gaasi toimimise kiiruse difusioon või efusioon. Grahami sõnul on kahe anumasse segatud gaasi difusiooni- ja efusioonikiirused alati pöördvõrdeline nende suhtelise tiheduse või molaarmasside ruuduga.
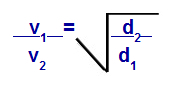
Grahami seadus tiheduse osas
v1 = gaasi 1 kiirus (efusioon või difusioon) segus;
v2 = gaasi 2 kiirus (efusioon või difusioon) segus;
d1 = segu gaasi 1 tihedus;
d2 = segu gaasi 2 tihedus;
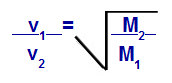
Grahami seadus, mis käsitleb molaarmissi
v1 = gaasi 1 kiirus (efusioon või difusioon) segus;
v2 = gaasi 2 kiirus (efusioon või difusioon) segus;
M1 = segu gaasi 1 molaarmass;
M2 = gaasi 2 molaarmass segus.
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
