Alus on anorgaaniline aine mis Rootsi keemiku sõnul Svante Arrhenius, kui see pannakse vette, kannatab nähtus iooniline dissotsiatsioon, milles on ioonid: katioon (Y+) ja hüdroksiidanioon (OH-).

Arrheniuse aluse üldvalem
a Y-rühm alus see võib olla mis tahes metall või ammooniumrühma (NH4+), mis eralduvad vees dissotsiatsiooni ajal katioonidena, nagu näeme protsessi esindavas võrrandis:
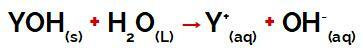
Aluse dissotsiatsiooni tähistav võrrand
Allpool leiate väga olulist teavet Euroopa Liitu klassifitseerimise ja nomenklatuuri kohta alused.
1) klassifikatsioon seoses aluste lahustuvus(võime lahustuma vees)
Alused lahustuv: koostises on leelismetall või ammoonium;
Alused raskesti lahustuv: on leelismuldmetall kompositsioonis. Näide: magneesiumhüdroksiid, mida kasutatakse laialdaselt antatsiidi ja lahtistina;
alused praktiliselt lahustumatu: kompositsioonis on mõni muu metall. Näide: alumiiniumhüdroksiid, mida kasutatakse laialdaselt antatsiidina.
2) Klassifikatsioon seoses rohujuure tugevus(võime eraldama vees)
Alused tugev: koostises on leelis- või leelismuldmetallid, välja arvatud magneesium;
Alused nõrk: kompositsioonis on mõni muu metall.
3) Põhinomenklatuur
Baasi nimetamiseks järgige lihtsalt allolevat nimereeglit:
Hüdroksiid + de + metalli või ammooniumi nimi
Näide: Ca (OH)2 → kaltsiumhüdroksiid
Kui aluses on keemiline element, mis ei kuulu IA, IIA või IIIA perekonda (ja see ei ole hõbe või tsink), peame tähistama elemendi nime ees rooma numbritega nende arvu hüdroksüülid:
Näide: Ti (OH)4 → titaanhüdroksiid IV
Minu poolt. Diogo Lopes
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm
