O aatomiraadius (r) on tavaliselt määratletud kui pool naaber aatomite kahe tuuma vahelisest kaugusest, nagu allpool olev joonis kujutab:

aatomiraadius
Aatomi raadius erineb perioodi tabelis perekonniti ja perioodi järgi. Seoses elementidega, mis kuuluvad a sama perekonna puhul suureneb aatomi raadius, kui aatomnumber suureneb., see tähendab ülevalt alla. Sest selles mõttes tähendab see, et ühest aatomist teise on energiatase või elektrooniline kiht tõusnud, mistõttu selle raadius suureneb proportsionaalselt.
Seoses elemendiga samal perioodil, see tähendab horisontaalselt, raadius suureneb paremalt vasakule või kui aatomnumber väheneb. Selle põhjuseks on asjaolu, et neil kõigil on sama arv kihte, erinevus on aga nende koguses nendes kihtides olevaid elektrone ja mida rohkem elektrone, seda suurem on külgetõmme tuuma suhtes, vähendades seeläbi aatom.

Aatomi raadiuse kasvusuund perekonna ja perioodi järgi Perioodilisustabelis
Kuid aatomi raadius võib varieeruda sõltuvalt loodud ühendusest. Vaatame, kuidas see juhtub:
* Ionic Bond: Kui aatom moodustab a katse, aatomi raadius väheneb, kuna ühe või mitme elektroni kaotamine meelitab tuum elektrone intensiivsemalt ligi. Nüüd kui moodustades aniooni ehk võimendavad elektrone, suureneb aatomi raadius, kuna elektrosfääri kogu laeng on suurem kui tuuma kogu laeng, vähendades selle atraktiivsust. Mida rohkem elektrone omandate või kaotate, seda suurem on varieerumine kiirte suuruses.
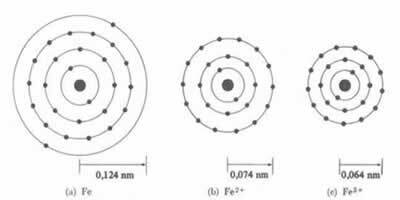
Katiooni läbimõõt või raadius on alati väiksem kui aatomi läbimõõt või raadius
Samuti seerias isoelektroonilised ioonid, millel on sama palju elektrone ja energiatasemeid, on väikseima aatomnumbriga ioonil suurem raadius. Näiteks ioonid 13Al3+, 12mg2+, 11Kell1+, 9F-1, 8O2- ja 7N-3, kõigil on 10 elektroni ja 2 elektroonilist taset. Kuid suurim raadius on 7N-3, kuna sellel on väikseim aatomnumber (Z = 7).
* Kovalentne side: Kui kaks aatomit seovad kovalentse sideme, kui kaks aatomit on võrdsednagu gaasilise vesiniku puhul (H2), võib rääkida kovalentsest raadiusest (r), mis on pool sideme pikkusest (d), see tähendab pool kahest tuumast eraldavast kaugusest. Kuigi, kui sideme tekitavad erinevad aatomidnagu vesinikkloriid (HCl) puhul, pikkus või kaugus (d) on kovalentsis osalevate aatomite kovalentsete raadiuste (r1 + r2) summa.
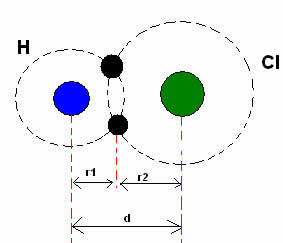
Aatomraadiuste summa kovalentses sidemes.
Muidugi peame meeles pidama, et see küsimus on palju keerulisem, kuna aatomi kovalentne raadius võib erineda, kuna see seondub teiste erinevate aatomitega.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm

