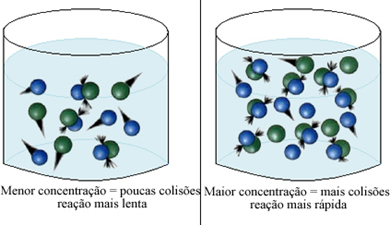
Me võime seda märkida alati, kui suurendame ühe või kõigi keemilises reaktsioonis osalevate reaktiivide kontsentratsiooni, suureneb selle arengukiirus, see tähendab reaktsiooni kiirus.
Samuti on vastupidi. Näiteks soovitatakse praegu tavalise alkoholi asemel kasutada alkoholigeeli, kuna on väiksem oht selle põlemiseks ja seeläbi õnnetuste vältimiseks. Tavaline vedel alkohol on tegelikult alkoholi ja vee segu, geelalkohol sisaldab väiksemas koguses alkoholi. Seega, kui ühe põlemisreaktiivi kontsentratsiooni vähendatakse, kulgeb reaktsioon alkoholi korral aeglasemalt. Teiselt poolt, mida puhtam alkohol, seda kiiremini põleb reaktsioon.

Nagu öeldud tekstis Keemiliste reaktsioonide esinemise tingimused, üks reaktsiooni toimumise tingimustest on tõhus kokkupõrge osakeste vahel. Seega reaktiivide kontsentratsiooni suurenemine võimaldab samas ruumis sulgeda suurema hulga osakesi või molekule. See suurendab nende vaheliste kokkupõrgete hulka ja suurendab tõenäosust, et toimuvad tõhusad kokkupõrked, mille tulemuseks on reaktsioon. Tulemuseks on see, et reaktsioon toimub kiiremini.
Selle nägemiseks mõelge järgmise näite peale: kui meil põleb sütel ja me tahame, et see põlemine kiiremini töötaks, siis kas me puhume või ventileerime parme? Miks see töötab?
Noh, selle põlemisreaktsiooni üks reaktante on õhus olev hapnik. Kui me raputame, eemaldab õhuvool põlemisel tekkiva tuha ja see hõlbustab hapniku kontakti süsinikuga. Sel viisil suurendame reaktantide vahelist kontakti ja kiirendame põlemisreaktsiooni.
Lühidalt, meil on:

Gaasidega töötamisel on üks võimalus reagentide kontsentratsiooni suurendamiseks alandage rõhku. Seda tehes vähendame mahtu ja järelikult suureneb reaktiivi kontsentratsioon.

Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm