THE lahustuvus või lahustuvuskoefitsient, see on aine füüsikaline omadus, mis määratakse alati praktiliselt laboris. See on seotud materjali nimega soluut, kingitused tuleb lahustada teisel, lahusti.
Lahustuvuse osas võib lahustunud aineid klassifitseerida järgmiselt:
Lahused: need, mis lahustuvad lahustis. Näiteks naatriumkloriid (soluut) lahustub vees (lahusti);
Veidi lahustuv: need, millel on raskusi lahustis lahustumisega. See on kaltsiumhüdroksiidi [Ca (OH)2] (lahustunud aine) vees;
Lahustumatud: need ei lahustu lahustis. Näiteks liiv (lahustunud aine) ei lahustu vees.
THE lahustuvus on väga seotud lahendusi (homogeensed segud), kuna lahuse saamiseks on oluline, et kasutatud soluut lahustuks lahustis.
Lahustuvust mõjutavad tegurid
Isegi kui lahustunud aine lahustub lahustis, võivad soluuti lahustumisvõimet mõjutada mõned tegurid. Kas nad on:
a) Soluudi ja lahusti koguse suhe
Lahustil on alati lahustuva aine piir, mida see suudab lahustada. Kui suurendame lahusti kogust, säilitades samal ajal lahustunud aine koguse, kipub lahusti lahustama kogu kasutatud lahustunud aine.
B) Temperatuur
Temperatuur on ainus füüsikaline tegur, mis suudab modifitseerida lahusti lahustuvust antud soluudi suhtes. See modifikatsioon sõltub soluudi olemusest, nagu näeme allpool:
endotermiline lahustunud aine: on see, mille abil suudame lahustada suurema massi, kui lahusti on toatemperatuurist kõrgemal temperatuuril. Mida kuumem lahusti, seda rohkem lahustunud aine lahustub.
Näide: Kui vesi on kuum, on võimalik suuremas koguses jahvatatud kohvi lahustada.
Eksotermiline lahustunud aine: on see, et meil õnnestub lahustada suurem mass, kui lahusti temperatuur on toatemperatuurist madalam. Mida külmem lahusti, seda rohkem lahustunud aine lahustub.
Näide: Kui sooda on külm, on võimalik suuremas koguses süsinikdioksiidi lahustada.
Lahustuvuse määramise viisid
Kuna lahustuvus on eksperimentaalselt määratud omadus, on materjalide lahustuvus juba hinnatud kõige erinevamates lahustites. Seega pääseme soluudi lahustuvusele teatud lahustis järgmiselt:
a) Tabeli analüüs
Sageli võib õpilane tabavuse tõlgendamisel kohata lahustuvust. Vaadake järgmist näidet:
Näide: (UEPG - kohandatud) Alltoodud tabel näitab Li-soola lahustuvust2CO3 100 grammis vees.

Tabelis on toodud Li mass grammides2CO3 mida saab lahustada 100 grammis vees, alates 0 OC kuni 50 OÇ. Näeme, et mida kuumem vesi, seda vähem on Li-d2CO3 lahustub. Seetõttu Li2CO3 see on eksotermiline lahustunud aine (see lahustub rohkem, kui vesi on külm).
b) Graafiku analüüs
Lahustuvust saab hinnata graafi tõlgendamise teel. Selleks määrake lihtsalt temperatuur, keerake see kõverale ja seejärel pöörake kõver y-teljele, mis on lahustunud aine mass grammides.
Näide: (UFTM - kohandatud) Graafik näitab AX-soola lahustuvuskõverat2.
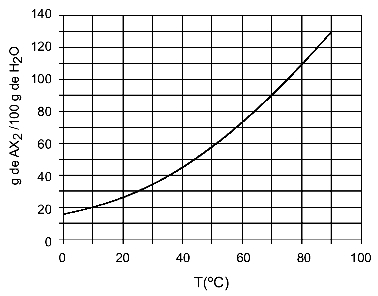
Graafik ütleb, et y-teljel on vee (lahusti) kogus 100 grammi. Lahustatud aine AX jaoks2, määrame veekoguse järgmistel temperatuuridel:
30OÇ: Kui lülitame temperatuuri 30 sisseOC kõverale ja seejärel kõver y-teljele, on meil sellel temperatuuril 100 grammi vett võimalik lahustada umbes 35 grammi lahustunud ainet AX2.
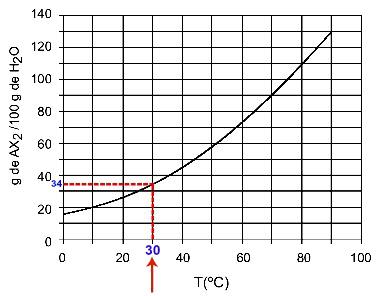
AX lahustuvuse määramine2 kell 30OÇ
40OÇ: Kui lülitame temperatuuri 40 sisseOC kõverale ja seejärel kõver y teljele, on meil sellel temperatuuril 100 grammi vett võimalik lahustada umbes 45 grammi lahustunud ainet AX2.
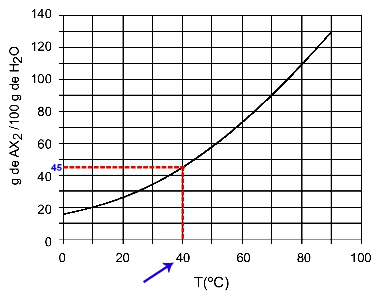
AX lahustuvuse määramine2 kell 40OÇ
Kuna lahustunud aine lahustunud kogus on iga temperatuuri tõusuga suurem, on meil AX2 see on endotermiline lahustunud aine.
c) teksti tõlgendamine
Vaadake järgmist näidet:
Näide: (PUC-MG) Teatud ained on võimelised moodustama homogeenseid segusid teiste ainetega. Aine, mida on kõige rohkem, nimetatakse lahustiks ja ainet, mida on kõige vähem, lahustunud aineks. Naatriumkloriid (NaCl) moodustab veega homogeense lahuse, milles on võimalik 20 ° C juures lahustada 36 g NaCl 100 g vees.
Tekstis öeldakse, et kui meil on 100 grammi vett (lahustit), temperatuuril 20 ° C OC, on võimalik lahustada kuni 36 grammi NaCl.
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm
