Üks pöörduv reaktsioon see tekib siis, kui on võimalik tooteid tagasi reageerijateks muuta. Selline reaktsioon tuleb sisse keemiline tasakaal kui otsese reaktsiooni arengukiirus, see tähendab reaktsioon reaktiivide tarbimisega ja tooted toimuvad sama kiirusega nagu pöördreaktsioon - reaktiivide moodustumine ja toodete tarbimine.
Seda tüüpi tasakaalustatud reaktsioone näeb igapäevaelus palju. Näiteks võib tuua koobastes, nn stalaktiitide ja stalagmiitide moodustumisel.
Põhjavesi on kõrge rõhu all, seega sisaldab see suures koguses süsinikdioksiidi (CO2 g)) selles lahustunud. Lubjakivi sisaldavate muldade läbimisel (CaCO3 (s)), see karbonaat lahustub ja moodustuvad koopad vastavalt allpool toodud reaktsioonile:
CaCO3 (s) + CO2 g) + H2O(1) → Ca2+(siin) + 2 HCO-3 (aq)
Karbonaat- ja kaltsiumioonid võivad aga reageerida, sadestudes uuesti kaltsiumkarbonaadina. Seda näitab reaktsioon:
Siin2+(siin) + 2 HCO-3 (aq)→ CaCO3 (s) + CO2 g) + H2O(1)
Nagu olete märganud, on üks reaktsioon vastupidine teisele: reagendid muutuvad toodeteks ja tooted reageerijateks. Niisiis, saame seda reaktsiooni tasakaalustatult kujutada järgmiselt:
CaCO3 (s) + CO2 (aq) + H2O(1) Siin2+(siin) + 2 HCO-3 (aq)
Siin2+(siin) + 2 HCO-3 (aq)
Koobaste katuselt mineraliseerunud tilkadest eraldub aeglaselt ja pidevalt karbonaati, nende vesi aurustub ja eraldub CO2. Niisiis nihutatakse keemiline tasakaal vastassuunas (reaktiivide moodustumine), seega CaCO3 (s) moodustub, see tähendab stalaktiidid koobaste katusel. Kukkumisel on tilk ikkagi lahustanud karbonaadi, mis ladestub koopa põrandale, moodustades stalagmiidid.
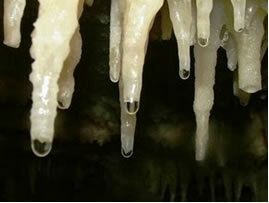
Vesi lubjakiviga, mis tilgub stalaktiitide ja stalagmiitide moodustumiseks
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/equilibrio-quimico-nas-cavernas.htm
