Hübriidumisteooria tekkis täiendusena Okteti teooria, mis suudab selgitada suurema hulga molekulide, sealhulgas boori (B) poolt moodustatud molekulide, struktuuri.
Sellel elemendil on viis põhiseisundi elektroni järgmise elektronkonfiguratsiooniga:
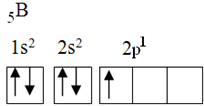
Oktetiteooria järgi sai boor luua ainult ühe kovalentse sideme, kuna sellel on ainult üks mittetäielik aatomorbiit. Eksperimentaalselt märgitakse siiski, et see element moodustab ühendeid, milles ta täidab rohkem kui ühte sidet.
Näitena võib tuua boortrifluoriidi (BF3). Nagu allpool näidatud, loob boor fluoriga kolm kovalentset sidet, jagades kolme paari elektronid ja selle viimases kestas (valentsikihis) on kuus elektroni, see tähendab erand reeglist oktett.
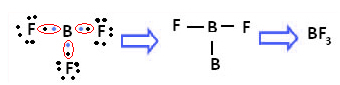
Seda seletatakse boori korral esineva hübridiseerumisnähtusega. Selgub, et 2. taseme elektron neelab energiat ja läheb ergastatud olekusse, milles ta hüppab alataseme 2p tühjale orbitaalile. Seega moodustub kolm mittetäielikku orbitaali, mis võivad nüüd luua kolm kovalentset sidet:
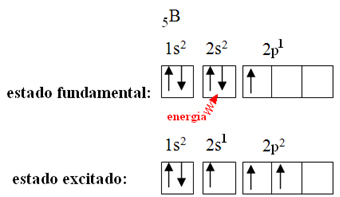
Kuid boortrifluoriidis tekkinud sidemed on kõik ühesugused, kuid kui vaatame ülalt, on kaks sidet erinevad, kuna üks neist oleks tehtud s-orbitaali ja teised kaks seda tüüpi orbiidi kaudu. tüüp p. Siin toimub hübridiseerumine, see tähendab, et mittetäielikud orbitaalid ühinevad, andes tulemuseks kolm
hübriidsed orbitaalid või hübridiseeritud, mis on identsed ja erinevad originaalidest: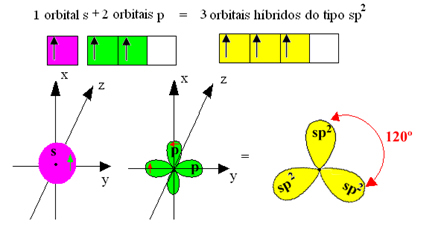
Kuna need hübriidorbitaalid koosnevad ühest orbitaalist ja kahest p orbitaalist, nimetatakse seda hübridisatsiooni sp² hübridiseerimine.
Booriga seonduval fluoril on üheksa elektroni. Selle elektrooniline levitamine ja orbitaalid on näidatud allpool:
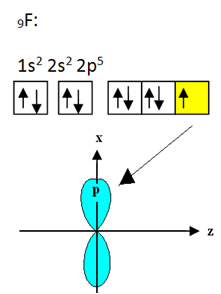
Pange tähele, et iga fluoriaatom võib luua ainult ühe kovalentse sideme ja selle sideme moodustav orbitaal on tüüpi p. Niisiis jälgige allpool, kuidas orbitaalid moodustuvad BF-i moodustavate ühenduste loomisel3 ja näete, kuidas lingid on identsed σp-sp2:
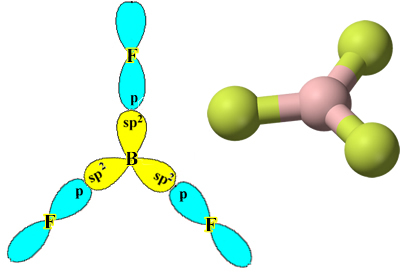
See juhtub ka teiste elementidega, vt näiteks teksti “Berülliumi hübridiseerimine”.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm

