Enamikus autodes kasutatakse kütusena bensiini ja etanooli. Nende kahe kütuse täielik põlemine tekitab süsinikdioksiidi (CO2 g)) ja vesi (H2O). Kahjuks võivad mittetäielik põlemine ning alkoholis ja bensiinis sisalduvad lisandid tekitada keskkonda väga saastavaid aineid. Bensiini puhul süsinikoksiid (COg)); süsivesinikud (süsinikust ja vesinikust koosnevad ühendid), nagu etaan (C2H6 g)); ja lämmastikoksiidid (NOx), peamiselt lämmastikmonooksiid (NO) ja lämmastikdioksiid (NO2 g)).
Seega, õhusaaste suurenemise vältimiseks vajavad kõik autod nn katalüüsmuundur või katalüsaator, mis on saastetõrjeseade, mille ülesandeks on töödelda neid sisepõlemismootori poolt eralduvaid gaase ja muuta need vähem kahjulikeks gaasideks. Mõnes tööstusprotsessis kasutatakse selleks ka katalüüsmuundureid.
Mainitud saasteainegaasid väljuvad mootorist ja sisenevad katalüsaatorisse, läbides teatud tüüpi taru, mille rakud on tavaliselt valmistatud keraamilisest või metallist materjalist, mis on kaetud alumiiniumoksiidiga (alumiiniumoksiid - Al
2O3). See kärgstruktuuri kuju koos väikeste kanalitega on oluline, kuna see tagab gaasidele suure kontaktpinna, pannes need kiiremini reageerima.Kuid tõeline katalüsaator on metall, mis asetseb alumiiniumoksiidi peal. Tavaliselt on kasutatud metallid pallaadium, roodium, plaatina või molübdeen. Võite ka neid metalle segada ja kasutada sulameid. Näiteks bensiini puhul kasutatakse tavaliselt pallaadiumi ja tooriumi sulamit; etanooli puhul kasutatakse teist pallaadiumi ja molübdeeni sulamit. Need metallid teostavad saastavate gaasidega heterogeenset katalüüsi.
heterogeenne katalüüs see on teatud tüüpi reaktsioon, mille käigus katalüsaator moodustab koos reagentidega (antud juhul saastavate gaasidega) polüfaaside süsteemi. Seda seetõttu, et katalüsaator adsorbeerub, see tähendab, et see hoiab reagentide molekule oma pinnal, nõrgendades nende sidemeid ja muutes reaktsiooniprotsessi kiiremaks.
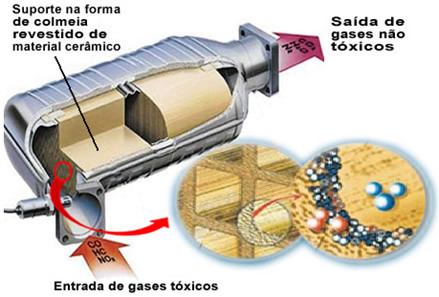
Selle tulemusena muudavad katalüsaatormetallid selliseid saasteaineid nagu CO ja NOx mittetoksilistes gaasides nagu CO2, H2O, O2 ja ei2. Vaadake mõnda neist reaktsioonidest allpool ja märkige, et nende kaudu toimub süsivesinike oksüdeerumine ja CO (saadud mittetäielikust põlemisest) ja ka lämmastikoksiidide redutseerimine gaasiliseks lämmastikuks (N2):
2 COg) + 2 EIg) → 2 CO2 g) + 1 N2 g)
2 COg) + 1 O2 g) → 2 CO2 g)
2C2H6 g) + 7 O2 g) → 4 CO2 g) + 6 H2Ov)
2 EI2 g) +4 COg) → 1 N2 g) + 4 CO2 g)
2 EI2 g) → 1 N2 g) + 2 O2 g)
2 EIg) → 1 N2 g) + 1 O2 g)
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm
