Oksüdatsiooni-redutseerimise reaktsioonid, mis toimuvad vesinikperoksiidi (vesinikperoksiidi vesilahus - H) juuresolekul2O2 (aq)) on erijuhtum, mida tuleb analüüsida eraldi, peamiselt selle tasakaalu osas. Seda seetõttu, et vesinikperoksiidis olevad oksügeenid, mille Nox on võrdne -1, võivad kas oksüdeeruda või redutseeruda.
Vaatame näiteks kahte juhtumit, kus see käitub kõigepealt oksüdeeriva (redutseeriva) ja seejärel redutseeriva (oksüdeeriva) ainena:
- oksüdeerija: kui vesinikperoksiid redutseerub, toimides oksüdeeriva ainena, tekitab see produktina vett.
Kui lisame vesinikperoksiidi lahuse lahusele, mis sisaldab jodiidi ioone (I-) happelises keskkonnas on meil:
H2O2 (aq) + I-(siin) + H+(siin) → H2O(1) + I2 (s)
Vaadake, et moodustuks vesi ja jood. Kuid selleks, et kontrollida, kas vesinikperoksiid toimis tegelikult oksüdeeriva ainena ja redutseerus, jälgige oksüdatsiooniarvude (NOx) määramist: *

Vesinikperoksiidi hapniku Nox väärtus vähenes -1-lt -2-le, arvestades, et see sai 1 elektroni. Kuid kuna meil on igas vesinikperoksiidi molekulis kaks hapnikku (H
2O2), on Noxi variatsioon võrdne 2-ga.Niisiis, nagu on näidatud tekstisRedoks tasakaalustamine", Vajalik samm reaktsioonide tasakaalustamiseks oksüdatsioon-redutseerimise meetodil on Noxi variatsioonide väärtuste ümberpööramine koefitsientide abil, mis on antud juhul järgmine:
* H2O2 = 2 (∆Nox) = 2 → 2 on I koefitsient-;
* Mina-= ∆Nox = 1 → 1 on H koefitsient2O2.
Seega on meil:
1 tund2O2 (aq) + 2 I-(siin) + H+(siin) → H2O(1) + I2 (s)
Teiste koefitsientide saavutamine katsete abil tasakaalustamise teel:
- Kuna 1. liikmes on kaks hapniku aatomit, peab 2. liikme vee koefitsient olema võrdne 2. Ja kuna 1. liikmes on ka kaks jodiidi iooni, on 2. liikme joodikoefitsient 1. Ärge unustage, et aatomite ja ioonide õige hulga leidmiseks igas liikmes tuleb indeks korrutada koefitsiendiga:
1 tund2O2 (aq) + 2 I-(siin) + H+(siin) → 2 H2O(1) + 1 I2 (s)
- Nüüd jääb alles ainult 1. liikme vesinikkatiooni tasakaalustamine ja selle koefitsient peab olema võrdne 2-ga, sest teises liikmes on sellel 4 vesinikku ja esimeses liikmes juba kaks:
1 tund2O2 (aq) + 2 I-(siin) +2 H+(siin) → 2 H2O(1) + 1 I2 (s)
- redutseerija: kui vesinikperoksiid oksüdeerub, toimides redutseerijana, tekitab see hapnikku (O2) tootena.
Vesinikperoksiidi redutseeriv näide on kokkupuutel kaaliumpermanganaadiga (KMnO4). Sellel ainel on väga iseloomulik violetne värv, kuid kokkupuutel vesinikperoksiidiga muutub see värvusetuks. Seda seetõttu, et kogu MnO ioonis sisalduv mangaan4- permanganaadi lahus redutseerub, põhjustades Mn iooni2+, nagu allpool näidatud:
+1 -1 +7 -2 +1 0 +2 +1 -2
H2O2 + MnO4-+ H+ →2 + Mn2++ H2O
Noxi arvutamisel näeme, et vesinikperoksiidi hapnik tegelikult oksüdeerub ja põhjustab mangaani redutseerumist:
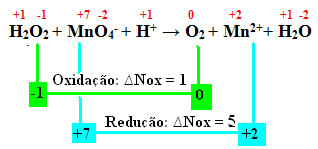
Nagu eelmises näites, võrdub vesinikperoksiidi oxNox 2-ga, kuna seal on kaks hapnikku ja kumbki kaotab elektroni. Seetõttu on meil:
* O2 = 2 (∆Nox) = 2 → 2 on MnO koefitsient4-;
* MnO4- = ∆Nox = 5 → 5 on O koefitsient2.
Ja nagu kõik O2 pärineb vesinikperoksiidist, on kahel ainel sama koefitsient:
5 H2O2 + 2MnO4-+ H+ → 5 O2 + Mn2++ H2O
Proovimeetodil tasakaalustades on meil:
5 tundi2O2 + 2 MnO4-+ 6 H+ → 5 O2 + 2 Mn2++ 8 H2O
* Kui teil on küsimusi selle kohta, kuidas arvutada reaktsioonis olevate aatomite ja ioonide oksüdatsiooninumber (Nox), lugege teksti „Oksüdatsiooninumbri (Nox) määramine”.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm
