Kujutage ette, et lisate 10 g lauasoola (naatriumkloriid - NaCl) klaasile, milles on 100 g vett temperatuuril 20 ºC. Pärast segamist näete, et sool on täielikult lahustunud, nii et otsustate soola veelgi lisada. Ühel hetkel ei saa te enam selles veekogus soola lahustada ja kogu lisatud sool vajub klaasi põhja, hoolimata sellest, kui palju proovite seda segada.
Kui see juhtub, ütleme, et lahendus on küllastunud ja et lahustuvuskoefitsient. Seetõttu saame lahustuvuskoefitsiendi määratleda järgmiselt:
“Lahustuvuskoefitsient on maksimaalne lahustunud aine kogus, mis lahustatakse teatud koguses lahustis ja temperatuuril. "
Näiteks soola lahustuvustegur vees on võrdne 36 g NaCl / 100 g vett temperatuuril 20 ° C. Selles veekoguses ja temperatuuril ei ole võimalik ekstra grammi soola lahustada lahustuvuskoefitsient on iga aine jaoks spetsiifiline. Kui muudame lahustunud ainet, asendades näiteks lauasool NH-ga4Cl, selle lahustuvuskoefitsient on võrdne 37,2 g 100 g vees temperatuuril 20 ° C.
Lisaks samal ainel on erinevates lahustites erinev lahustuvus.
Kuigi sool lahustub vees, ei lahustu see praktiliselt atsetoonis ega etüülatsetaadis (glasuuride eemaldamiseks kasutatav lahusti).Teine punkt on see, et kui mainitakse lahustunud aine koefitsienti antud koguses lahustis, samuti on vaja näidata temperatuuri, kuna see on segav tegur. Näiteks kui võtta 100 g vett temperatuuril 20 ° C ja lisada 40 g soola, lahustub 36 g ja 4 g moodustab sade. Kuid kui võtame selle lahenduse kuumutamisele, näeme, et 4 g lahustub temperatuuri tõustes.
See näitab meile, et sama lahustis, mis on lahustatud samas koguses lahustis, on temperatuuri tõustes erinevad lahustuvuskoefitsiendid.
Vaadake näidet allpool:
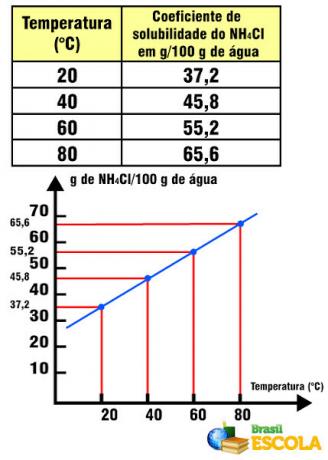
NH lahustuvuskoefitsient4Cl temperatuuri suhtes
Pange tähele, et sel juhul on NH lahustuvuskoefitsient4Cl tõuseb temperatuuri tõustes. See juhtub enamiku soolade vees. Siiski on olukordi, kus lahustuvuskoefitsient temperatuuri tõustes väheneb, nagu Ce puhul2(AINULT4)3. On ka juhtumeid, kus lahustuvuskoefitsiendis pole nii märgatavat varieeruvust, nagu juhtub lauasoolaga. Vaadake seda tekstist Lahustuvuskõverate graafikud.
Võib juhtuda, et saame teatud spetsiifilistes olukordades lahustada lahustis ka lahustunud koefitsiendist suurema koguse soluuti, saades nii nn. üleküllastunud lahus. Näiteks kujutage ette, et lahus, mis moodustub 100 g veest 20 ° C juures ja 40 g lauasoolast (koos 36 g lahustunud ja 4 g sadestunud) kuumutatakse, kuni see saavutab kogu lahustunud aine temperatuuri solubiliseerige ennast. Seejärel jäetakse see lahus puhkama, et see jahtuks, kuni jõuab toatemperatuurini, mis on lähedal 20 ºC.
Kui lahuses ei esine häireid, jääb lisaaine lahustunuks, moodustades seega üleküllastunud lahuse. Seda tüüpi lahus on aga väga ebastabiilne ja igasugune äkiline liikumine võib põhjustada selle temperatuuri lahustuvustegurist suurema koguse kristallumise. Seega lahendus, mis oli üleküllastunud saab küllastunud taustkehaga.
Viimane juhtum on küllastumata lahus, mis tähendab, et lahustunud lahustunud aine kogus on väiksem kui lahustuvuskoefitsiendi väärtus. Näide on 10 g NaCl lahustamine 100 g vees 20 ° C juures.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm

