ionisatsioon on keemiline nähtus, kus happeline aine (mille üldvalem on HX) tekitab vees lahustatuna kaks iooni: hüdrooniumkatiooni (H3O+ või H+) ja mis tahes anioon (X-). Nähtust esitatakse võrrandist. Vaata:
HX + H2O → H3O+ + X-
Ionisatsiooni ajal tohib ainult hape need muundatakse hüdrooniumkatioonideks, teguriks, mis sõltub ka selle happe ionisatsioonivõimest, see tähendab ionisatsiooniastmest (α). Seega ei moodusta mitte kõik vesinikud hüdrooniumit, välja arvatud juhul, kui happe ionisatsiooniaste on 100%.
Kui aga oleme ehitades ionisatsioonivõrrandi, me ei võta arvesse happe ionisatsiooniastet, vaid selle hulka ioniseeritavad vesinikud et ta esitleb.
Reeglina peame ioniseeruvat vesinikku kogu vesinikus, mis on vesinikhappes. Oksühapete korral on ioniseeritavad ainult süsinikuaatomitega seotud vesinikud, nagu on näha allpool toodud struktuurivalemist:
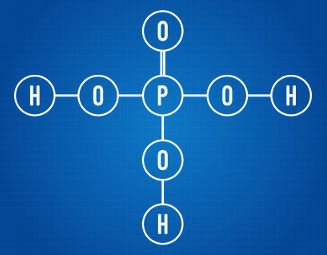
Fosforhappel on kolm ioniseeruvat vesinikku
Eespool toodud struktuurivalemit analüüsides näeme, et kõnealusel happel on kolm vesinikuaatomit, mis on seotud hapniku aatomitega. Sellisena on sellel kokku kolm ioniseerivat vesinikku.
Vaadake mõnda montaaži näidet mõnede hapete ionisatsioonivõrrand:
Näide 1: Vesinikbromiidhape (HBr)
HBr + H2O → H3O+ + Br-
Vesinikbromiidhape on vesinikhape, mille koostises on ainult üks vesinik. Kuna kogu vesinik vesinikus võib olla ioniseeritud, moodustub see vees lahustudes ainult üks mool hüdrooniumkatiooni see on bromiidanioon (Br-).
Näide 2: Vesiniksulfiid (H2S)
H2Y + 2 H2O → 2 H+ + S-2
Vesiniksulfiid on oma koostises kahe vesinikuga vesinikhape. Kuna kogu vesinik vesinikus võib olla ioniseeritud, moodustub see vees lahustudes kaks mooli hüdrooniumkatioone see on sulfiidanioon (S-2). Selleks me kasutasime kaks mooli vett.
Näide 3: mangaanhape (H2MnO4)
H2MnO4 + 2 H2O → 2 H3O+ + MnO4-2
Mangaanhape on oksihape, mille koostises on kaks vesinikku. Nagu oksihapetes, on ioniseeritav ainult hapnikuga seotud vesinik - mangaanhappe puhul on need kaks vesinikku -, siis see moodustub vees lahustudes, kaks mooli hüdrooniumkatioone see on manganaatanioon (MnO4-2). Selleks me kasutasime kaks mooli vett.
Näide 4: Fosforhape (H3TOLM3)
H3TOLM3 + 2 H2O → 2 H3O+ + HPO3-2
Fosforhape on oksühape, mille koostises on kolm vesinikku. Kuna oksühapetes on ioniseeritav ainult hapnikuga seotud vesinik - fosforhappe puhul on need kaks vesinikku -, siis see moodustub vees lahustumisel kaks mooli hüdrooniumkatioone see on fosfitioonioon (HPO3-2). Selleks me kasutasime kaks mooli vett.
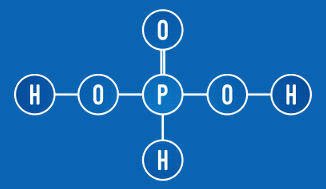
Fosforhappel on kaks ioniseerivat vesinikku (rühm rühm OH)
Näide 5: Boorhape (H3BO3)
H3BO3 + 3 H2O → 3 H+ + BO3-3
Boorhape on oksühape, mille koostises on kolm vesinikku. Nagu oksühapetes, on ioniseeritav ainult hapnikuga seotud vesinik - boorhappe puhul on need kolm vesinikku -, siis moodustub see vees lahustumisel kolm mooli hüdrooniumkatioone see on boraatanioon (BO3-3). Selleks me kasutasime kolm mooli vett.
Näide 6: Pürofosforhape (H4P2O7)
H4P2O7 + 4 H2O → 4 H3O+ + P2O7-4
Pürofosforhape on oksihape, mille koostises on neli vesinikku. Nagu oksühapetes, on ioniseeritav ainult hapnikuga seotud vesinik - boorhappe puhul on neli vesinikku -, moodustub see vees lahustumisel neli mooli hüdrooniumkatioone see on anioonpürofosfaat (P.2O7-4). Selleks me kasutasime neli mooli vett.
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/equacoes-ionizacao-dos-acidos.htm
