Et perioodilise tabeli perekonnad on tabeli vertikaalsed jadad ja kogunevad keemilised elemendid sarnaste keemiliste omadustega. Sellised sarnasused tulenevad samasse perekonda rühmitatud elementide võrdse koguse valentselektronide olemasolust. Pered mahutavad esinduselemendid rühmadesse 1 ja 2, 13-18 ja üleminekuelemendid rühmadesse 1-12.
Loe ka:Transuraanelemendid – inimtekkelised keemilised elemendid, mis tulevad perioodilises tabelis pärast uraani
Perioodilise tabeli perede kokkuvõte
Pered vastavad vertikaalsetele joontele Perioodilisustabel.
Tuntud ka kui rühmad, on perioodilises tabelis perekonnad nummerdatud vahemikus 1 kuni 18.
Sama perekonna keemilistel elementidel on sarnased keemilised omadused.
Elementide hulga tuttavust seletatakse võrdse arvu valentselektronidega.
Esinduselemendid jagunevad rühmadesse 1, 2, 13, 14, 15, 16, 17 ja 18. Igal neist perekondadest on konkreetsed nimed.
Üleminekuelemendid moodustavad ühtse perekonna, mis on jagatud rühmadesse 3, 4, 5, 6, 7, 8, 9, 10, 11 ja 12.
Perioodilise tabeli perede organiseerimine
Pered perioodilises tabelis on tabeli vertikaalsed jadadst veerud. Tuntud ka kui rühmad, perioodilise tabeli perekonnad on nummerdatud vahemikus 1 kuni 18, vasakult paremale.
Ühes veerus asuvaid keemilisi elemente peetakse samasse perekonda kuuluvateks., mis on tingitud nende keemiliste omaduste sarnasusest, mis tuleneb sellest, et neil on sama arv elektronid juures valents kest. Näiteks kõigil 18. perekonna keemilistel elementidel on valentskihis (täiskestas) kaheksa elektroni ja nad osalevad harva keemilised sidemed.
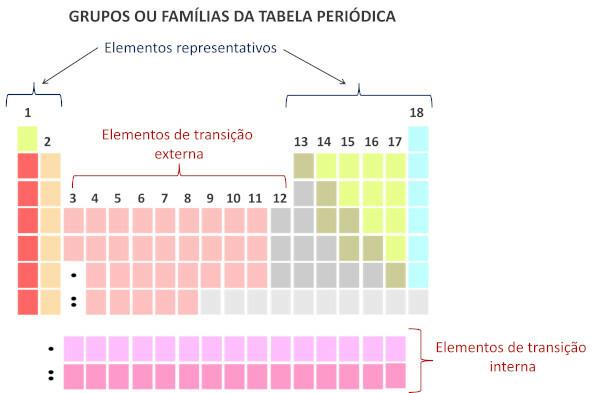
Vastavalt kaasaegsele süsteemile Rahvusvaheline Puhta ja Rakenduskeemia Liit (Iupac), tähistatakse iga rühma või perekonda perioodilises tabelis vasakult paremale algava numbriga 1 kuni 18.
Oluline on rõhutada, et vana IUPAC-süsteem võttis kasutusele tähtnumbrilise süsteemi, kus tähed A ja B viitavad vastavalt esindus- ja üleminekuelementidele. Praegu seda tüüpi nomenklatuuri enam ei kasutata.
Perioodilise tabeli perekondade nomenklatuur
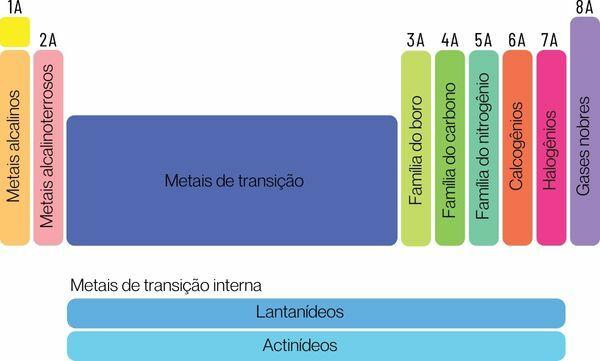
Keemilised elemendid võib liigitada kahte suurde perekonda: esinduselemendid ja üleminekuelemendid.
→ Perioodilise tabeli tüüpilised elemendid
Esinduselemendid jagunevad rühmadesse 1, 2, 13, 14, 15, 16, 17 ja 18. Igal neist rühmadest on konkreetne nimi, mille järgi saab seda ka teada. Vaata:
1. rühm: perekond metallid aluseline.
2. rühm: perekond leelismuldmetallid.
13. rühm: boor- või muldmetallide perekond.
14. rühm: süsiniku perekond.
15. rühm: Lämmastiku või pnikogeenide perekond.
16. rühm: hapniku või kalkogeeni perekond.
17. rühm: perekond halogeenid.
18. rühm: perekond väärisgaasid.
→ Periooditabeli üleminekuelemendid
Sina üleminekuelemendidmoodustavad ühe perekonna, mis on jagatud rühmadesse 3, 4, 5, 6, 7, 8, 9, 10, 11 ja 12. Lantaniidide ja aktiniidide seeriad on samuti osa üleminekuelementidest.
Üleminekuelemendid on kõik metallist ja neil on sarnased keemilised omadused, isegi kui valentskihis on erinevad elektronid, ja seepärast moodustaks see ühe ja suure siirdemetallide perekonna.
Keemilised elemendid perioodilise tabeli perekondadest
Iga perekond või rühm koosneb keemiliste elementide komplektist. Vaadake iga perekonna moodustavate keemiliste elementide kirjeldust:
1. rühm:liitium, naatrium, kaalium, rubiidium, tseesium, frantsium.
2. rühm:berüllium, magneesium, kaltsium, strontsium, baarium, raadio.
3. rühm:skandium, ütrium, lantaniidi seeria ja aktiniidi seeria.
4. rühm: titaan, tsirkooniumoksiidO, hafnium see on rutherfordium.
5. rühm:vanaadium, nioobium, tantaal see on dubnium.
6. rühm:kroomitud, molübdeen, volfram see on seaborgium.
7. rühm:mangaan, tehneetsium, reenium see on bohrio.
8. rühm: raud, ruteenium, osmium see on hassium.
9. rühm:koobalt, roodium, iriidium ja meitnerium.
10. rühm:nikkel, pallaadium, plaatina ja darmstadtio.
11. rühm: vask, hõbedane, kullast ja roengenium.
12. rühm:tsink, kaadmium, elavhõbe ja Kopernik.
13. rühm: boor, alumiiniumist, gallium, indium ja tallium.
14. rühm: süsinik, räni, germaanium, tina, juhtima ja flerovium.
15. rühm:lämmastik, luminofoor, arseen, antimoni see on vismut.
16. rühm:hapnikku, väävel, seleen, telluur, poloonium ja livermorium.
17. rühm: fluor, kloor, broom, jood ja astatiin.
18. rühm:heelium, neoon, argoon, krüptoon, ksenoon see on radoon.
Tähtis: keemiline element vesinik on erijuhtum, sest vaatamata sellele, et see asub rühma 1 kõrval, ei kuulu see leelismetallide perekonda, kuna sellel ei ole sarnaseid keemilisi omadusi.
Tea rohkem: Millised on radioaktiivsed elemendid perioodilises tabelis?
Perioodilise tabeli perekondade peamised omadused
→ 1. rühm või leelismetallide perekond
Need on metallist tahked ained, läikivad ja siledad.
Neil on kõrge soojusjuhtivus ja kõrge Elektrijuhtivus.
on temperatuurid suhteliselt madala sulamistemperatuuriga.
Nad on väga reageerivad vesi.
Kalduvus moodustada ühevalentseid katioone (laeng +1).
→ 2. rühm või leelismuldmetallide perekond
Need on metallilised tahked ained, läikivad ja leelismetallidega võrreldes kõvemad.
Need oksüdeeruvad kergesti.
Neil on kõrge soojusjuhtivus ja kõrge elektrijuhtivus.
Neil on leelismetallidega võrreldes veidi kõrgem sulamistemperatuur.
Nad reageerivad veega.
Kalduvus moodustada kahevalentseid katioone (laeng +2).
→ Rühmad 3 kuni 12 või siirdemetallide perekond
Nad on perioodilise tabeli suurim perekond.
Kõvad, läikivad metallilised tahked ained.
Neil on kõrge soojusjuhtivus ja kõrge elektrijuhtivus.
Tihe.
Kõrged sulamistemperatuurid.
võivad esineda erinevalt oksüdatsiooniseisundid.
→ Rühm 13 ehk booriperekond
Neil on vahepealsed omadused metallide omaduste ja mitte metallid.
Need on ümbritseva keskkonna tingimustes tahked.
Kalduvus moodustada kolmevalentseid katioone (laeng +3).
→ Rühm 14 ehk süsiniku perekond
Neil on metallide ja mittemetallide omaduste vahepealsed omadused.
Need on ümbritseva keskkonna tingimustes tahked.
Kalduvus moodustada neli sidet.
Need on ümbritseva keskkonna tingimustes tahked.
Süsinik ja räni võivad moodustada ahelsidemeid.
→ Rühm 15 ehk lämmastikuperekond
Neil on metallide ja mittemetallide omaduste vahepealsed omadused.
Tahked ained ümbritseva keskkonna tingimustes, välja arvatud lämmastik, mis on gaas.
Lämmastik ja fosfor on elusorganismide põhilised.
Arseen on väga mürgine.
→ Rühm 16 ehk hapniku perekond (kalkogeenid)
Neil on erinevad omadused, muutudes mittemetallist metalliliseks elemendiks, kui lähete perekonna alla.
Tahked ained ümbritseva keskkonna tingimustes, välja arvatud hapnik, mis on gaas.
Kalduvus moodustada kahevalentseid anioone (laeng -2).
→ Rühm 17 või halogeenide perekond
Need on mittemetallid.
Üsna reaktiivne.
Halvad soojus- ja elektrijuhid.
Välistingimustes eksisteerivad fluor ja kloor kui gaasid, broom on vedel ja jood tahke.
Kalduvus moodustada monovalentseid anioone (laeng -1).
→ Rühm 18 ehk väärisgaaside perekond
Need on mittemetallid.
Väga vähe reaktiivsed, nii et neid võib nimetada inertgaasideks.
Need eksisteerivad gaaside kujul.
Neil puudub kalduvus moodustuda ioonid.
Perioodiline tabel ja elektrooniline levitamine
Samasse perekonda või rühma kuuluvatel keemilistel elementidel on sarnased keemilised omadused, kuna neil on võrdne arv elektrone valentskihis.
Elektronide arv valentskihis on oluline, kuna see määrab katioonide moodustumise tendentsi või anioonid, tekkiva keemilise sideme tüüp, keemilistes reaktsioonides osalev energia jne omadused. Valentselektronide arvu leidmiseks on vaja teada aatomnumber elemendist ja täida oma elektrooniline levitamine.
→ Esinduselementide elektrooniline levitamine
Esinduslikud elemendid nende kõige energilisemad elektronid on alamtasanditel s see on P elektroonilise kihi (n). Järgmine tabel koondab iga tüüpiliste elementide perekonnaga seotud elektroonilised konfiguratsioonid. terminit n varieerub vahemikus 1 kuni 7 ja tähistab valentselektronide poolt hõivatud energiataset, mis on samaväärne perioodilise tabeli perioodiga (horisontaalne joon), milles element on leitud.
Esinduselementide elektrooniline levitamine | ||
perekond või rühm |
Elektrooniline levitamine |
Näide |
1 |
meie1 |
Li (Z=3): 1 s2 2s1 |
2 |
meie2 |
Ole (Z=4): 1 s2 2s2 |
13 |
meie2 np1 |
B (Z=5): 1 s2 2s22p1 |
14 |
meie2 np2 |
C (Z=6): 1 s2 2s22p2 |
15 |
meie2 np3 |
N (Z=7): 1 s2 2s22p3 |
16 |
meie2 np4 |
O (Z=8): 1 s2 2s22p4 |
17 |
meie2 np5 |
F (Z=9): 1 s2 2s22p5 |
18 |
meie2 np6 |
Ne (Z=10): 1 s2 2s22p6 |
→ Üleminekuelementide elektrooniline jaotus
Üleminekuelemendid on jaotatud rühmade 3 ja 12 vahel ning omama alamtasemeid d see on f hõivatud valentselektronidega:
Välised üleminekuelemendid: hoida valentselektrone alamtasemel d, hoides elektronide konfiguratsiooni võrdsena meie2 (n-1)d(1 kuni 8). Näiteks element nikkel (Z = 28) kuulub rühma 10 ja selle konfiguratsioon on 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Sisemised üleminekuelemendid: nad on osa 3. rühmast, kuid on perioodilise tabeli "sisemised", laienedes selle alla, perioodidel 6 (lantaniidid) ja 7 (aktiniidid). Nendel elementidel on valentselektronid, mis hõivavad alamkihi f ja üldine elektrooniline konfiguratsioon meie2 (n-2)f(1 kuni 13). Näiteks element lantaan (Z = 57) on lantaniidirea esimene element ja selle elektronkonfiguratsioon on 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Tea ka:Mis on perioodilise tabeli päritolu?
Lahendas harjutusi perioodilise tabeli perede kohta
küsimus 1
(UFC – kohandatud) Seoses kaasaegse perioodilise elementide klassifikatsiooniga märkige õige väide:
A) Perioodilises tabelis vastavad perekonnad või rühmad horisontaaljoontele.
B) Perekonna elementidel on väga erinevad keemilised omadused.
C) Perekonnas on elementide viimases kestas üldiselt sama arv elektrone.
D) Ajavahemikul on elementidel sarnased keemilised omadused.
E) Esinduslikud elemendid on jaotatud rühmadesse 3 kuni 12.
Resolutsioon:
Alternatiiv C
Üksus A on vale: perekonnad või rühmad on perioodilise tabeli veerud (vertikaalsed jooned).
Üksused B ja D valed: perekonnas on elementidel sarnased keemilised omadused. Perioodidel on elementidel sama elektronkiht, mis on hõivatud valentselektronidega.
Punkt C õige: perekonnas on elementide viimases kestas sama arv elektrone.
Element E on vale: tüüpilised elemendid on rühmad 1, 2, 13, 14, 15, 16, 17 ja 18. Üleminekuelemendid on jaotatud rühmadesse 3 kuni 12.
küsimus 2
(EAM) Elementidel A, B ja C on valentskihtides järgmine elektronkonfiguratsioon:
A: 3s1
B: 4s2 4p4
C: 3s2
Selle teabe põhjal valige õige valik.
A) Element A on leelismetall.
B) Element B on halogeen.
C) Element C on kalkogeen.
D) Elemendid A ja B kuuluvad perioodilisuse tabeli kolmandasse perioodi.
E) Kolm elementi kuuluvad perioodilise tabeli samasse rühma.
Resolutsioon:
Alternatiiv A
Punkt A õige: elemendil A on elektrooniline jaotus, mis sisaldab ainult ühte valentselektroni, seega kuulub ta perioodilisuse tabeli 1. rühma.
Vale element B: elemendil B on 4 sekundi elektronkonfiguratsioon2 4p4, mis näitab, et viimases kestas on 6 elektroni ja see element kuulub 16. rühma (kalkogeenid).
Vale element C: elemendil C on elektrooniline konfiguratsioon, mille viimases kestas on 2 elektroni, seega on see tabelis 2. rühma element.
Vale element D: element A kuulub kolmandasse perioodi (n = 3) ja element B kuulub neljandasse perioodi (n = 4).
Vale element E: kolmel elemendil on viimases kestas erinev kogus elektrone, mistõttu nad ei saa kuuluda samasse perekonda.
Autor Ana Luiza Lorenzen Lima
Keemia õpetaja
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/familias-da-tabela-periodica.htm
