Et lämmastiku funktsioonid on rühm orgaanilised ühendid millel on aatomid lämmastik süsinikahela külge kinnitatud. Neid eristavad vastavad funktsionaalrühmad, mis on teatud konfiguratsioonis ühendatud aatomite komplektid, mis määravad iga funktsiooni iseloomulikud omadused.
Lämmastiku funktsioonid on järgmised:
amiinid;
amiidid;
nitroühendid;
nitriilid;
isonitriilid.
Loe ka:Millised on hapniku funktsioonid?
Lämmastiku funktsioonide kokkuvõte
Lämmastiku funktsioonid on orgaanilised ühendid, mis sisaldavad aatomid lämmastikust.
Amiinid, amiidid, nitroühendid, nitriilid ja isonitriilid on lämmastikufunktsioonid.
Anorgaanilisi funktsioone eristatakse nende funktsionaalrühma järgi.
Amiinid saadakse asendamisel vesinikud ammoniaaki alküülradikaalide poolt.
Amiididel on sama süsinikuaatom, mis on seotud lämmastiku ja süsinikuga. hapnikku.
Nitroühendid sisaldavad -NO rühma.2.
Nitriile iseloomustab kolmikside olemasolu süsiniku ja lämmastiku vahel.
Isonitriilidel on kolmikside lämmastiku ja süsinik, süsinikuahelaga seotud lämmastikuga.
Videotund lämmastiku funktsioonide kohta
Mis on lämmastiku funktsioonid?
Lämmastiku funktsioonid on komplekt orgaanilised funktsioonid, mille struktuuris on lämmastikuaatom, lisaks süsiniku- ja vesinikuaatomitele. Need on: amiinid, amiidid, nitroühendid, nitriilid ja isonitriilid,
Lämmastikufunktsioone eristavad vastavad funktsionaalrühmad, mis on aine omaduste eest vastutav aatomite struktuurne paigutus.
Millised on lämmastiku funktsioonid?
amiinid
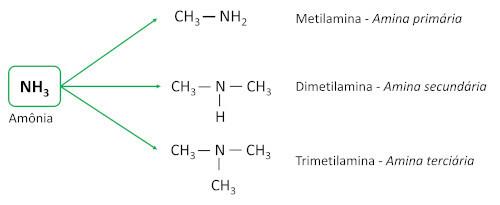
Orgaaniline funktsioon kaevandus on iseloomustatud vähemalt ühe süsinikuahela sidumisega lämmastikuaatomiga. Amiinide funktsionaalne rühm on -N-R1R2R3 (R-rühmad on süsinikuahelad või vesinikuaatomid, millest vähemalt üks on süsinikuahel).

amiinid on saadud ammoniaagist (NH3), kus üks või mitu vesinikuaatomit on asendatud süsinikuaatomite või alküülligandidega. Need on põhiained, jättes pH rohkem kui 7 vesilahuses.
Neid klassifitseeritakse süsiniku ligandidega (alküül- või arüülrühmadega) asendatud vesinikuaatomite hulga järgi, mida nimetatakse asendajateks.
- Primaarsed amiinid: neil on üks süsiniku asendaja.
- Sekundaarsed amiinid: neil on kaks süsiniku asendajat.
- tertsiaarsed amiinid: neil on kolm süsiniku asendajat, see tähendab, et lämmastikuaatom ei ole enam seotud ühegi vesinikuaatomiga, moodustades kolm Ühendused lihtne süsinikuaatomitega.
A amiinide nomenklatuur järgib juhiseid IUPAC (International Union of Pure and Applied Chemistry). Primaarsete amiinide puhul arvestatakse nimetuse koostamisel süsinikuaatomite arvu (eesliide), süsinikuvahelise sideme olemust (infiks) ja kasutatakse terminit kaevandus järelliide jaoks (sõna lõpp).

Vaata näidet:
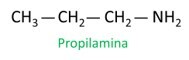
Kui määrate süsinikudele radikaalide asukoha jaoks numbreid, määrake NH-rühmale kõige lähemal olevale aatomile väikseim võimalik arv.2.
Sekundaarsete ja tertsiaarsete amiinide puhul arvestab nomenklatuur pikimat lämmastikuga seotud asendusrühma põhiahelana ja teised ligandid kirjutatakse süsiniku arvule viitava eesliite ja sufiksiga -il, mille ees on N-täht.

Näide:
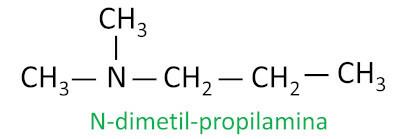
Amiidid
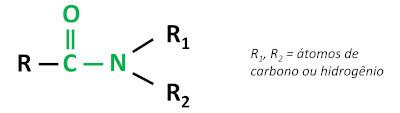
Orgaaniline funktsioon amiid iseloomustab karbonüülrühma (C=O) sidumine lämmastikuaatomiga, kus lämmastik võib olla seotud süsiniku või vesiniku aatomitega.
amiidid on põhiainedjättes vesilahuse pH üle 7. Aine karbamiid kuulub amiidide rühma ja on uriinis looduslikult esinev ühend, mis on saadud elusorganismides toimuvatest lagunemisprotsessidest.
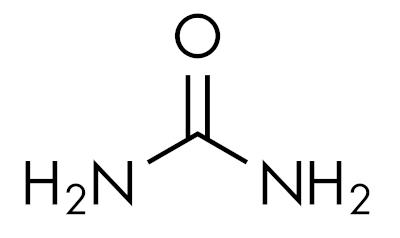
Amiidid on iseloomulikud sõltuvalt lämmastiku asendustasemest. Nagu nii:
- Primaarsed amiidid: hoiavad kahte vesinikuaatomit koos lämmastikuga.
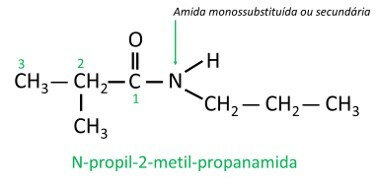
- Sekundaarsed amiididvõi monoasendatud: üks vesinikuaatomitest on asendatud süsiniku ahel, seega säilitab lämmastik vesinikuga üksiksideme.
- tertsiaarsed amiididvõi ümberasustatud: Lämmastikus ei ole enam vesiniksidemeid, need kõik on asendatud süsinikutega.

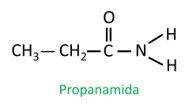
Amiidid on Nimetatud IUPACi järgi, molekulid on nimetatud järjestuse järgi:

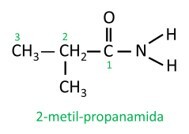
Hargnenud amiidis osaleb amiidrühma süsinikuaatom peaahelas ja süsiniku loendus peab algama sellest. Vaata:
 |
 |
Monoasendatud või diasendatud amiidides on täht N näitab haru asukohta mis on seotud lämmastikuaatomiga. Kui ahelas on mõni muu radikaal, kirjutatakse see pärast N-le viitava radikaali tuvastamist.
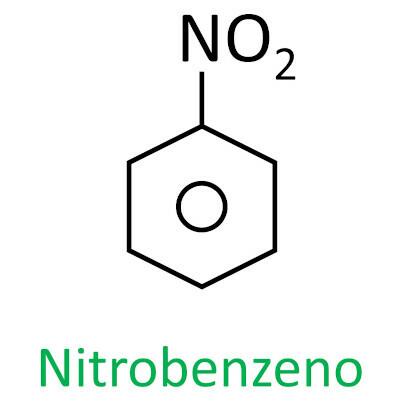
nitroühendid
Sina nitroühendid on orgaanilised ühendid, mis sisaldavad nitrorühma (-NO2), mis on kinnitatud süsinikahela külge, mis võib olla alifaatne (avatud või lineaarne) või aromaatne.
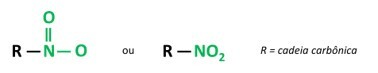
A nende ainete peamine omadus on nende plahvatusvõime. Plahvatusvõime on seotud aromaatsete nitroühenditega ja mida suurem on nitrorühmade arv, seda suurem on plahvatus. Alifaatseid nitroühendeid kasutatakse laborites orgaaniliste lahustitena.
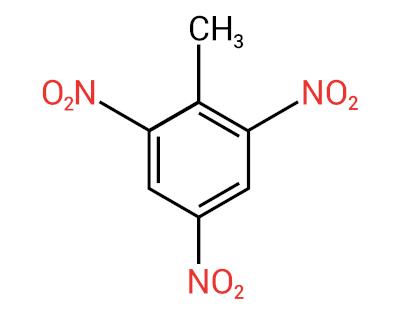
Nende ühendite nomenklatuuri moodustab sõna nitro millele järgneb nimi süsivesinik (eesliide + infix + lõpp -O).
Vaadake mõnda näidet:
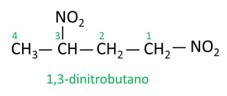 |
 |
nitriilid
Nitriilid on orgaanilised ühendid, mida iseloomustavad kolmikside süsinikuaatomi ja lämmastikuaatomi vahel, esitades funktsionaalrühma – C ≡ N. Nitriilides on lämmastik lõpus ja süsinik on seotud otse süsinikuahelaga.

nitriilid Tuntud ka kui tsüaniidid, kuna need tulenevad reaktsioonidest vesiniktsüaniidhappega (HCN).
need on ained inimestele mürgine, sest kehas võivad nad kokkupuutel maohappega moodustada vesiniktsüaniidhapet, takistades sellega seotud protsesse rakuhingamine rakkudest.
Looduses võib nitriile leida mõningates luuviljalistes, kuid väga väikeses kontsentratsioonis, mis ei kujuta endast ohtu, ja loodusliku manioki lehtedes.

Nitriilide nomenklatuuri Iupac-reegel määratleb selle termini nitriil lisatakse järelliitena:

Vaadake mõnda näidet:
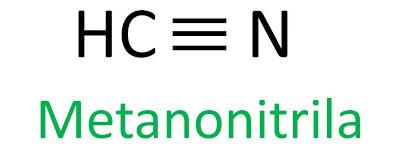 |
 |
Nitriilide nomenklatuuri tavaline vorm on tsüaniid + radikaalne nimi.
isonitriilid
Isonitriilid ehk isonitriilid on ühendid, mis moodustuvad kolmikside süsinikuaatomi ja lämmastikuaatomi vahel, esitades funktsionaalrühma – R ≡ C. Isonitriilides on süsinik lõpus ja lämmastik on seotud otse süsinikuahelaga.

Isonitriilid erinevad nitriilidest lämmastiku- ja süsinikuaatomite asukoha tõttu ning Isonitriilides iseloomustatakse lämmastikku heteroaatomina., kuna see paikneb kahe süsiniku vahel.
Need on ebastabiilsed liigid ja võivad kõrgel temperatuuril muutuda nitriilideks. Isotsüaniidhappe reaktsioonid tekitavad isonitriile, mistõttu neid ühendeid tuntakse ka isotsüaniididena.
Isonitriili molekulid järgivad nimetamisel Iupaci reeglit:
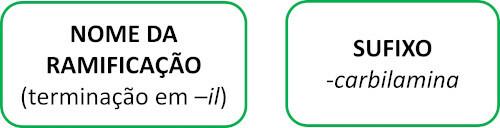
Vaadake mõnda näidet:
 |
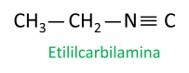 |
Lämmastiku funktsioonide rakendused
Lämmastiku funktsioonide hulka kuuluvatel ainetel on palju rakendusi, peamiselt tööstuses, et valmistada polümeerid, kummi, sünteetilised kiud, ravimid, agrokemikaalid, pestitsiidid ja lõhkeained.
Et amiine kasutatakse värvainete tootmisel, seebid, ravimid, protsessis kummi vulkaniseerimine, lõhkeaineid ja muid tööstuslikke protsesse ning neid leidub ka taimedes ja moodustuvad orgaanilise aine lagunemisprotsessides.

Et amiide kasutatakse laialdaselt tööstus- ja keemiasektoris, mida kasutatakse polümeeride (nagu nailon ja polüuretaan), vaikude, lõhkeainete, väetised, putukatõrjevahendid, väetised ja ravimid.

Sina nitroühendidSelle peamine rakendusala on lõhkeainete tootmine. mida kasutatakse sõjalises, tööstus- ja metallurgiasektoris (tooraine kaevandamiseks). Üks tuntumaid nitroühendeid on trinitrotolueen, rahvasuus tuntud kui TNT. Muud nitroühendite rakendused on tootmises pestitsiidid, bakteritsiidid, värvained, nafta rafineerimine jne.

Et nitriile kasutatakse orgaaniliste lahustitena laboris ja tööstuses, osaledes mõnede sünteetiliste kiudude, plastpolümeeride, värvainete ja väetiste ekstraheerimisel ja tootmisprotsessides.

Et isonitriile kasutatakse erinevates protsessides orgaaniliste ühendite tootmiseks, näiteks lahustid, ning osalevad agrokemikaalide, pestitsiidide, kummide ja plastide valmistamisel.
Loe ka:Halogeniidid - ained, mille süsinikuahelaga on seotud halogeeniaatomid
Lahendati harjutusi lämmastiku funktsioonide kohta
küsimus 1
(FPS-PE-modifitseeritud) Lämmastikuühendite kasutamine sünteetilises orgaanilises keemias on väga mitmekesine ja hõlmab ravimite, värvainete, lõhkeainete ja vitamiinide valmistamist. Vaadake allolevaid ühendeid.
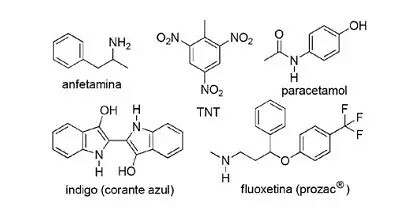
Nende ühendite kohta märkige vale väide.
a) TNT on nitroühend.
b) Fluoksetiini lämmastikku sisaldav osa on sekundaarne amiin.
c) Amfetamiin on klassifitseeritud primaarseks amiidiks.
d) Indigo struktuuris on heteroaromaatsed tsüklid.
e) Paratsetamooli lämmastikku sisaldav osa on amiid.
Resolutsioon:
Täht C
Üksus The on õige, sest TNT on nitroühend, kuna sellel pole rühmi2.
Üksus B on õige. Fluoksetiini lämmastikku sisaldav osa on sekundaarne amiin, kuna see on seotud kahe süsiniku segmendiga.
Üksus w on vale, kuna amfetamiin on klassifitseeritud primaarseks amiiniks, mitte amiidiks. Pange tähele, et käesolev rühm on NH2. Nii et see on küsimuse tuum.
Üksus d on õige, kuna indigo struktuuris on heteroaromaatsed tsüklid, st tsüklid, mis on moodustatud süsinikuaatomitest ja teisest elemendist - antud juhul lämmastikust.
Üksus see on on õige, sest paratsetamool on amiid, mis sisaldab lämmastiku ja hapnikuga seotud süsinikku.
küsimus 2
(UFMS) Yerba mate (Ilex paraguariensis), mis on pärit Lõuna-Ameerikast, kasutatakse toonilise ja ergutava joogina. Valmistamiseks võib kasutada yerba mate lehtede töötlemisel saadud toodet chimarrão ja tereré ning muud joogid, mida tavaliselt ja kultuuriliselt tarbitakse Argentina, Paraguay ja Brasiilia. Suur huvi yerba mate vastu on tingitud keemilistest ühenditest, mis on tingitud selle antioksüdantsetest, stimuleerivatest ja diureetilistest omadustest.
(Saadaval: http://repositorio.utfpr.edu.br/jspui/bitstream/1/3158/1/PG_PPGEP_Henrique%2C%20 Flavia%20Aparecida_2018.pdf. Juurdepääs: 01. nov. 2018. Kohandatud).
Yerba mate stimuleerivad omadused on seotud selle metüülksantiinide sisaldusega, millest üks peamisi on kofeiin, mille struktuur on esitatud allpool:

Kofeiini struktuurivalemit analüüsides on õige väita, et sellel on järgmised orgaanilised funktsioonid ja omadused:
a) aluseline aldehüüd ja amiid.
b) amiin ja amiid, aluseline.
c) amiin ja ketoon, aluseline.
d) ketoon ja amiid, amfoteerne.
e) aluseline karboksüülhape ja amiin.
Resolutsioon:
Täht B
Kofeiini struktuuri analüüsimisel tuvastatakse amiini ja amiidi funktsionaalrühmad, nagu on näidatud alloleval pildil. Kuna neil kahel rühmal on aluseline või aluseline omadus, on see omadus ka kofeiinil, mis tähendab, et kofeiini vesilahuste pH on üle 7.
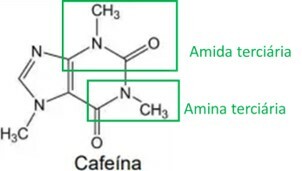
Autor Ana Luiza Lorenzen Lima
Keemia õpetaja
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/funcoes-nitrogenadas.htm


