THE aku on süsteem, kus toimub oksüdatsiooni-redutseerimise reaktsioon. Selles seadmes muundatakse spontaanses reaktsioonis tekkiv keemiline energia elektrienergiaks.
Oksüdatsiooni- ja redutseerimisreaktsioonid toimuvad rakus samaaegselt. Kui üks liik oksüdeerub, loovutab see teisele liigile elektrone, mis nende vastuvõtmisel redutseeritakse.
Seetõttu on oksüdeeriv aine redutseerija ja redutseeriv aine oksüdeerija.
THE oksüdatsioon tekib siis, kui liik kaotab elektronid ja muutub katiooniks: A → A+ + ja-.
THE vähendamine tekib siis, kui liik saab elektrone ja muutub elektriliselt neutraalseks: B+ + ja- → B.
Keemilistes võrrandites on see elektronide ülekanne Seda näitab oksüdatsiooniarvu (nox) muutus.
Rakkude sees toimuvad redutseerimisreaktsioonid ja elektrivool tekib elektronide migreerumisel negatiivselt poolusele.

Kuidas virn töötab?
Üks redoksreaktsioon saab üldiselt esitada võrrandiga:
A + B+ → A+ + B
kus,
V: Aine, mis oksüdeerub, kaotab elektrone, suurendab oma väärtust ja on redutseerija.
B: aine, mis redutseerub, omandab elektrone, vähendab oksüdatsiooni ja on oksüdeeriv aine.
Vaadake järgmisel pildil, kuidas seda protsessi saab kujutada.
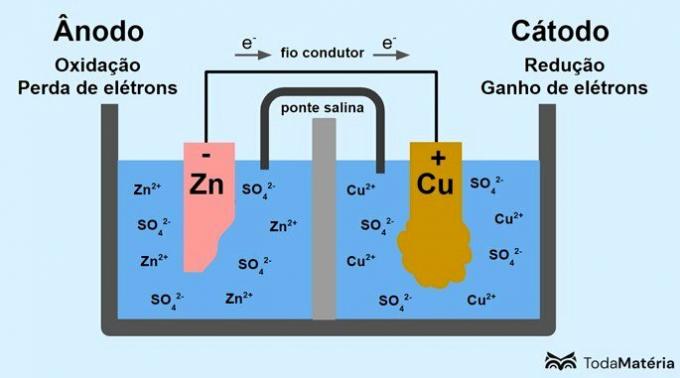
Kaheks poolrakuks jagatud süsteemi, mis on moodustatud kahest metallelektroodist, mis on väliselt juhtiva juhtmega ühendatud, töötas välja John Frederic Daniell (1790-1845) 1836. aastal.
Aku koosneb kahest elektroodist, mis on ühendatud juhtiva juhtmega, ja elektrolüüdist, kus asuvad ioonid. Elektrood on tahke juhtiv pind, mis võimaldab elektronide vahetust.
anood: elektrood, millel toimub oksüdatsioon. See on ka aku negatiivne poolus.
Katood: elektrood, mille juures toimub redutseerimine. See on ka aku positiivne poolus.
Ülaltoodud pildil on metalliline tsink anoodiks ja see läbib oksüdatsioon. Metalliline vask on katood ja läbib redutseerimise. Elektronide migratsioon (e-) toimub anoodilt katoodile läbi juhtiva traadi.
Pildisüsteemis esinevad reaktsioonid on järgmised:
- anood (oksüdatsioon): Zn(s) → Zn2(siin) + 2e-
- Katood (vähendamine): Cu2+(siin) + 2e- → perse(s)
- üldvõrrand: Zn(s) + perse2+(siin) → perse(s) + Zn2+(siin)
Tsink on metall, millel on suurem kalduvus kaotada elektrone ja seetõttu tekivad lahuses katioonid. Tsinkelektrood hakkab kuluma ja kaotab massi, kuna tsink eraldub Zn katioonide moodustumisel lahusesse2+.
Anoodilt tulevad elektronid jõuavad katoodile ja metallikatioonid muudetakse nende vastuvõtmisel metalliliseks vaseks, mis sadestub elektroodile ja suurendab selle massi.
Soolasild on ioonvool, mis vastutab ioonide ringluse eest süsteemis, et hoida seda elektriliselt neutraalsena.
Lugege ka oksüdatsiooniarv (nox).
aku tüübid
Rakus määrab keemiliste liikide kalduvuse elektrone vastu võtta või loovutada redutseerimispotentsiaal.
Suurima redutseerimispotentsiaaliga komponent kipub redutseerima, st omandama elektrone. Madalaima redutseerimispotentsiaaliga ja sellest tulenevalt ka suurima oksüdatsioonipotentsiaaliga liigid kalduvad elektrone üle kandma.
Näiteks redoksreaktsioonis Zn0(s) + perse2+(siin) → perse0(s) + Zn2+(siin)
Tsink oksüdeerib ja loovutab elektrone, kuna sellel on redutseerimispotentsiaal E0 = -0,76 V, väiksem kui vase E redutseerimispotentsiaal0 = +0,34 V ja seetõttu võtab see vastu elektrone ja redutseerub.
Vaadake altpoolt teisi virnade näiteid.
Tsingi ja vesiniku virn
Oksüdatsiooni poolreaktsioon: Zn(s) → Zn2+ + 2e- (JA0 = -0,76 V)
Redutseerimise poolreaktsioon: 2H+(siin) + 2e- → H2(g) (JA0 =0,00 V)
Globaalne võrrand: Zn(s) + 2H+(siin) → Zn2+(siin) + H2(g)
Virna esitus:
Vase ja vesiniku rakk
Oksüdatsiooni poolreaktsioon: H2(g) → 2H+(siin) + 2e- (JA0 = 0,00 V)
Redutseerimise poolreaktsioon: Cu2+(siin) + 2e- → perse(s) (JA0 = +0,34 V)
Globaalne võrrand: Cu2+(siin) + H2(g) → 2H+(siin) + perse(s)
Virna esitus:
Sisu abil saate teema kohta rohkem teadmisi:
- elektrokeemia
- Elektrolüüs
Bibliograafilised viited
FONSECA, M. R. M. keemia, 2. 1. toim. São Paulo: Atika, 2013.
SANTOS, W.L.P; MOL, G.S. Kodanikukeemia, 3. 2. toim. São Paulo: toimetaja AJS, 2013.
USBERCO, J. Ühenda keemia, 2: keemia. - 2. toim. São Paulo: Saraiva, 2014.



