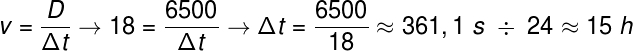THE oganesson, sümbol Og, aatomnumber 118, on seni suurima aatomnumbriga keemiline element perioodilises tabelis. Seda looduses ei leidu ja selle tootmine on kunstlik, seega peetakse seda sünteetiliseks elemendiks. Sellest hoolimata on selle valmistamine väga keeruline ja seda peetakse väga haruldaseks elemendiks, kuna seda on väga vähe sünteesitud.
Vaatamata sellele, et nad kuuluvad samasse rühma väärisgaasid, ei ole oganessoonil arvutuste kohaselt palju omadusi, mis nendele elementidele viitaksid matemaatikud näitavad, et ülirasked elemendid kannatavad relativistlike mõjude tagajärjel.
Element 118 sünteesiti esmakordselt 2002. aastal ioonide reaktsiooni kaudu 48Ca koos aatomitega 249Vaata Selle nimi on austusavaldus vene teadlasele Juri Oganessianile, kes on üliraskete elementide alal üks austatumaid ja tunnustatumaid.
Vaata ka: Rutherfordium – teadlase Ernest Rutherfordi järgi nime saanud sünteetiline keemiline element
Kokkuvõte oganessoni kohta
Oganessoon on sünteetiline keemiline element, mis asub rühmas 18 Perioodilisustabel.
See sünteesiti esmakordselt 2002. aastal Venemaa ja Ameerika teadlaste ühistöös.
See moodustab 2016. aastal perioodilisustabelisse viimati lisatud elementide rühma.
See on väga haruldane element, mida on väga vähe sünteesitud.
Nende uuringud on veel väga hiljutised, põhiomadused määratakse endiselt arvutuste ja matemaatiliste mudelite abil.
Esialgsed teoreetilised testid näitavad, et vaatamata väärisgaaside rühma kuulumisele, distantseerivad mõned omadused Og teistest elementidest.
Oganessooni tootmine toimub Tuumasünteesi, kasutades ioone 48Ca ja selle aatomid 249Vaata
Selle nimi on austusavaldus vene teadlasele Juri Oganessianile, kes on üliraskete elementide uurimise alal üks olulisemaid.
Oganessoni omadused
Sümbol: oh
Aatomnumber: 118.
Aatommass: 294 c.u. (mitteametlik, Iupac).
Elektrooniline konfiguratsioon: [Rn] 7s2 5f14 6d10 7p6.
Kõige stabiilsem isotoop: 294Og (0,69 millisekundi poolestusaeg, mida saab suurendada 0,64 millisekundi võrra või vähendada 0,22 millisekundi võrra).
Keemiline seeria: rühm 18, ülirasked elemendid, väärisgaasid.
Oganessoni omadused
Oganesson on seni ametlikuks tehtud kõrgeima aatomarvuga element (118). Rahvusvaheline Puhta ja Rakenduskeemia Liit (IUPAC). Kuigi see toodeti esmakordselt 2002. temast teatakse vähe. Palju on veel spekuleeritud, kuna seda elementi looduses ei leidu. Selle tootmine toimub laboris, mis konfigureerib selle sünteetilise elemendina.
Lisaks sinu pool elu on vähem kui millisekund (10-3 teine) — meeles pidada, et poolväärtusaeg on aeg, mis kulub koguse poole võrra vähenemiseks. Seetõttu pole selle elemendi jaoks ette nähtud omadused muud kui selle tulemused matemaatilistel mudelitel põhinevad teoreetilised arvutused, kuna perioodilise tabeli piirkonnas, kus see on leiab relativistlikud efektid (relatiivsusteooriast tulenev lahknevus oodatud ja täheldatud mõju vahel) on olulised.
Relativistlikud efektid viivad Ogi eemale sellest, mida temalt oodati. Element näiteks ei käitu väärisgaasidega sarnaselt. Arvutused näitavad, et oganessoon oleks toatemperatuuril tahke aine sulamistemperatuuriga vahemikus 325 ± 15 K (umbes 52 °C) ja keemistemperatuur vahemikus 450 ± 10 K (umbes 177 °C).
Samuti on teada, et Og võib olla reaktiivsem kui teised väärisgaasid, kuna relativistlikud efektid võimaldavad tal p-alataseme elektrone kergemini kaotada. Veel üks väärisgaasidega vastuolus olev punkt on see, et oganessoon on a pooljuht, samas kui teised on isolaatorid.
Loe ka: Vesinik – keemiline element, millel on perioodilises tabelis väikseim aatomnumber
Oganessoni saamine
Nagu teisedki ülirasked elemendid, saadakse oganesson tehnika abil, mida nimetatakse kuum sula, kus isotoobi ioonid 48Ca, mida leidub looduslikult, kuid väga vähe saadaolevalt, reageerib palju raskemate isotoopidega, tekitades üliraskeid elemente.
Og on nii haruldane ja raskesti kättesaadav element, et Kümne aasta jooksul vaid neli aatomid hakati tootma. Põhimõtteliselt tootmine 294Og, ainus teadaolev isotoop, tekib ioonide pommitamise teel 48Ca tuumani 249Vt 3 neutroni vabanemisega.
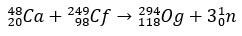
Mõne millisekundilise poolestusajaga Og tuvastati selle lagunemismustri kaudu, midagi väga levinud üliraskete elementide puhul. Sel juhul toimus 3 alfalagunemist, mille tulemusena muutus element 118 koperitsiumiks Cn, mis lõpuks läbis spontaanse lõhustumise.
oganessoni ajalugu
Esimene oganessooni süntees toimus 2002. aastal., Livermore'i linnas Californias, Ameerika Ühendriikides Lawrence Livermore'i riiklikus laboris, kus rühm Ameerika teadlasi tegi koostööd Venemaa teadlastega Vene teadlase Juri Oganessiani juhitud kuulsast Tuumauuringute Ühisinstituudist (JINR).
Kümne aasta jooksul alates esimesest sünteesist sünteesiti reaktsiooniparameetrite harulduse ja keerukuse tõttu vaid neli oganessooni aatomit. Neljas ja viimane aatom tegi aga uskumatu avastuse.
Teadlased üritasid sünteesida elementi 117 reaktsiooni kaudu 48Ca koos 249Bk aga märgati, et 28% berkeliumi sihtmärgist läbis β-lagunemise, mis muundus 249Vt ja seega genereerides elementi 118. Tähelepanuväärne on, et elemendi 118 nimi austab vene teadlast Juri Oganessianit, austusavaldus, mida elavatele keemikutele on keemia ajaloos esinenud vaid kaks korda, esimene neist Glenn Seaborgile, seaborgium.
Lahendas harjutusi oganessonil
küsimus 1
Oganessoon, element aatomnumbriga 118 ja sümboliga Og, paigutati perioodilise tabeli seitsmendasse perioodi väärisgaaside rühma. Selle tulemusena on palju spekuleeritud selle üle, kas selline element annaks suure stabiilsuse, mis on tuntud selle rühma teistele elementidele. Og jaotamine rühma 18 oli tingitud:
A) see element on väga stabiilne.
B) selle elemendi valentskihis on kaheksa elektroni.
C) see element on toatemperatuuril ilmselt gaas.
D) sellel elemendil on samad keemilised omadused kui teistel väärisgaasidel.
E) sellel elemendil on kõrge ionisatsioonienergia.
Resolutsioon:
Alternatiiv B
Og jaotamine toimub ainult ja eranditult selle alusel elektrooniline levitamine. Asjaolu, et selles on kaheksa elektroni valentskiht, 7s2 7p6, paneb selle sellesse asendisse. Uuringud selle elemendiga on veel esialgsed, kuid juba spekuleeritakse matemaatiliste tulemuste tõttu, et näiteks Og ei ole toatemperatuuril gaas. Veel üks punkt, mida tuleb esile tõsta, on see, et Og ei ole üldse stabiilne, isegi mitte looduses eksisteeriv.
küsimus 2
Elemendi 118 valmistamise suured raskused tekitavad idee, et teadlased olid selle tuvastamiseks tõelisel odüsseial. Pole ime, et pärast kümmet aastat kestnud esimest sünteesi sünteesiti oganessoni veel kolm korda. Ja siiani on teada ainult üks isotoop, 294oh Mitu neutronit on teadaoleval oganessoni isotoobil?
A) 294.
B) 118.
C) 176.
D) 412.
E) 166.
Resolutsioon:
Alternatiiv C
Arv neutronid Og-i saab arvutada järgmiselt:
A = Z + n
A on arv pasta aatomiline, Z on prootonite arv (või aatomarv) ja n on neutronite arv. Väärtuste asendamisel on meil:
294 = 118 + n
n = 294-118
n = 176
Autor Stefano Araújo Novais
Keemia õpetaja
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/oganessonio-og.htm