THE rutherfordium on sünteetiline element aatomnumbriga 104, mis kuulub rühma 4 Perioodilisustabel, olles esimene transaktiniidide seeria liige. Selle esimene avastamine pärineb aastast 1964 Dubna linna kuulsates laborites. Nagu teisedki transaktiniidid, osales elemendi 104 ametlik nimetus Nõukogude ja ameeriklaste vahelises konfliktis külma sõja aegses keemia ajaloos.
rutherfordium sellel pole praktilisi rakendusi, arvestades, et selle kõige stabiilsemal isotoobil on umbes kaks ja pool tundi pool elu. Kuid uuringud gaasiliste süsteemide ja lahustega tõestavad selle keemilist sarnasust 4. rühma teiste elementidega, nagu tsirkoonium ja hafnium.
Loe ka: Seaborgium – teadlase Glenn Seaborgi järgi nime saanud sünteetiline element
Rutherfordiumi kokkuvõte
- See on sünteetiline keemiline element, mis asub perioodilise tabeli 4. rühmas.
- See sünteesiti esmakordselt 1964. aastal Venemaal Dubnas asuvas Tuumauuringute Ühisinstituudis.
- See on radioaktiivne elementvanaema.
- Sarnaselt teistele transaktiniididele on rutherfordiumil madal stabiilsus ja uuringute jaoks on raske sünteesida märkimisväärseid proove.
- Selle nimi tehti ametlikuks alles 1997. aastal, pärast mitu aastat kestnud vaidlust ameeriklaste ja nõukogude vahel.
Rutherfordiumi omadused
- Sümbol: Rf
- aatomnumber: 104
- aatommass: 267 c.u.s.
- Elektrooniline konfiguratsioon: [Rn] 7s2 5f14 6d2
- kõige stabiilsem isotoop: 267Rf (poolväärtusaeg 2,5 ± 1,5 tundi)
- keemiline seeria: rühm 4, transaktiniidid, ülirasked elemendid
Rutherfordiumi omadused
Nagu kõik transaktiniidid, st elemendid vahetult pärast laurence'i (Lr), rutherfordium on radioaktiivne element. Selle kõige stabiilsem isotoop avastati 2004. aastal ja selle poolestusaeg (aeg, mis on vajalik radioisotoop poole võrra) on kaks ja pool tundi, veamarginaaliga poolteist tundi, enam-vähem.
Suured raskused rutherfordiumi ja teiste keemiliste omaduste kindlaksmääramisel transaktiniidid on üldiselt asjaolu, et tootmismäär on madal, kas koguseliselt või koguseliselt kiirus. Nendes elementides on näiteks väga levinud keemiliselt hinnata ainult ühte aatom, mis teatud mõttes nõuab arvutustes kohandusi, kuna enamik võrrandeid on kehtestatud rohkem kui ühe aatomiga süsteemide jaoks. Lisaks sageli isotoopide poolestusaeg on väga lühike, mis muudab põhjalikumad uuringud keeruliseks või isegi võimatuks.
Rf konkreetse juhtumi puhul on teadlased juba suutnud tõestada, et selle käitumine vedelas faasis on sarnane teiste elementide omaga. kergem rühm 4, tsirkoonium ja hafnium, nagu fluoriidide moodustamisel lahuses koos järgneva ekstraheerimisega ioonvahetusvaikudes. See käitumine aitas tugevdada rutherfordiumi esinemist perioodilise tabeli 4. rühmas.
Loe ka: Uued keemilised elemendid — neli puuduvat elementi 7. perioodil
Rutherfordiumi saamine
Transaktiniidid vajavad oma tootmiseks suurt infrastruktuuri. Kõik sünteesitakse koos osakeste kiirendid, milles ioonilised liigid põrkuvad raskete elementidega. Nende elementide tuvastamine pole samuti lihtne ja arusaadav.
Moodustunud radioaktiivne element hakkab oma olemuselt lagunema ja avaldab emissioone, nagu alfa- ja beetaosakesed. Sageli on vaja hinnata radioaktiivne lagunemine moodustunud aatomi kohta või isegi tuvastada tuumareaktsioonidest tekkida võivaid aatomiliike, nagu mõistatuses.
Lisage see asjaolule, et transaktiniidi isotoopide poolestusajad on sageli lühikesed, vahemikus sekundit, mistõttu on võimalik saada vaid mõne aatomi vahemikku jääv kogus või isegi üks aatom.
Rf puhul hõlmas selle elemendi esimene süntees Plutooniumi isotoopide Pu kokkupõrge neooni isotoobi 22 ioonidega, Ah.
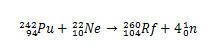
Teisi rutherfordiumi isotoope saab aga toota, muutes põrkuvaid liike. Näiteks isotoopi 261 saab toota hapniku-18 ja kuurium-248 vahelisel reaktsioonil, tekitades viis neutronit.
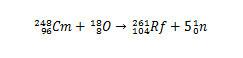
Vaadake seda meie podcastist: Kuidas osakeste kiirendi töötab?
Ettevaatusabinõud Rutherfordiumiga
Kuna rutherfordiumit ei saa isegi märkimisväärses mahus toota, on selle elemendiga seotud riskid seotud mõjud kiirgust. Kontrollitud laboris on need riskid aga ette nähtud ja seega viidud miinimumini.
Rutherfordiumi ajalugu

Kõik transaktiniidid osalesid 1960. ja 1970. aastatel nende avastamise võidujooksus. Sellest episoodist teatatakse kui Ülekannete sõda, tükk Külm sõda keemia ajaloos. Vaatamata sellele, et seda nimetatakse nii, mis viitab sellele, et vaidlused tekkisid elementide pärast pärast fermiumi, elementi aatomnumber 100, otseselt seotud elemendid olid 104 kuni 109, äsja avastatud transaktiniidid.
Rutherfordiumi puhul sai vaidlus alguse 1964. aastal., mil nõukogude teadlased Dubna linna Tuumauuringute Ühisinstituudis Venemaa teatas elemendi 104 isotoobi 260 avastamisest plutoonium-242 ioonidega pommitamise teel neoon-22. Kuid Dubna teadlased esitasid ainult ühe tõendi, milleks oli isotoobi tuvastamine mis on spontaanselt lagunenud, ilma et oleks selgelt määratletud selle mass ja aeg pool elu. Seetõttu suhtuti avastusse kahtlustavalt.
Viis aastat hiljem, 1969. aastal töötas Californias Berkeleys asuvas Lawrence Berkeley riiklikus laboris Ameerika teadlaste meeskond eesotsas Albert Ghiorso ütles, et esitas piisavalt tõendeid elemendi 104 isotoobi 257 avastamiseks kalifornium-249 kokkupõrkes süsinik-12. Samad teadlased suutsid hiljem toota elemendi 104 isotoobi 259. 1973. aastal kinnitasid Oak Ridge'i riikliku labori teadlased sõltumatult aatomnumber 104 Berkeleys toodetud massiga 257 isotoobi jaoks.
Järgnevad aastad olid kahe riigi teadlaste vahel suured vaidlused, kuni 1985. aastal Puhta ja Rakenduskeemia (IUPAC) ning Rahvusvahelise Puhta ja Rakendusfüüsika Liidu (IUAP) vorm a üheksast teadlasest koosnev segakomisjon nimega Transfers Working Group (Transfermiumi töörühm ehk TWG). TWG loodi selleks, et otsustada, kes tegelikult vastutab elementide 101–112 avastamise eest.
Sellegipoolest ei olnud tehnilise töörühma otsused alati vaieldamatud. Elemendi 104 puhul otsustas töörühm, et Au tuleks jagada Nõukogude ja Ameerika teadlaste vahel, mis Berkeley teadlastele üldse ei meeldinud.
1991. aastal väitsid Ghiorso ja Seaborg Berkeley meeskonnast isegi, et Dubna teadlased tuvastasid elemendi 104 selgelt vale ja ühel hetkel eitas TWG järelduste kehtivust, pidades neid kogukonnale karuteene teaduslik.
Pole ime, sisse 1990. aastate alguses ei olnud uute elementide nimetused ikka veel üksmeelel.. Seejärel peeti läbirääkimisi Saksa, Vene ja Ameerika teadlastega, mis osutusid pettumuseks. Seal pakkus Saksa labor Gesellschaft für Schwerionenforschung (GSI) 1992. aastal välja elementidele 102–109 nimed, pannes elemendile 104 meitneriumi.
Sellegipoolest ei võtnud asjassepuutuvad teadlased nimekirja, vaatamata sellele, et seda kiideti. Otsuse võis vastu võtta 1994. aastal Iupac Anorgaaniliste Ühendite Nomenklatuuri Komisjoni (CNIC) konverentsi ajal. Selles valiti elemendile 104 nimi dubnium, kuid American Chemical Society võttis samal aastal kasutusele elemendi 104 nimetuse rutherfordium. element 104, ameeriklaste diskrediteerimise hetkel, kes seadsid kahtluse alla IUPAC-i volituse vormistada uusi nimed.
alles 1997. aastal, Genfis toimuval IUPACi üldkonverentsil, on see element 104 muudeti lõpuks ametlikuks rutherfordiumina, pärast seda, kui ACS andis järele teiste lähedalasuvate elementide nomenklatuuris.
Rutherfordiumil lahendatud harjutused
küsimus 1
Rutherfordium on sünteetiline element ja üks peamisi raskusi selle uurimisel on asjaolu, et seda ei ole võimalik suures koguses sünteesida.
Võimalike tegurite hulgas, mis seda raskust põhjustavad, võime märkida:
(A) Rutherfordiumil on pika poolestusajaga isotoobid, mis ulatuvad miljonite aastate suurusjärku.
(B) Rutherfordium laguneb spontaanselt ja väga kiiresti, takistades selle makroskoopiliste koguste tuvastamist.
(C) Rutherfordiumi sünteesimiseks pole ühtegi tehnoloogiat, nende andmed on rangelt teoreetilised ja ilma teadusliku aluseta.
(D) Keemiaseadused ütlevad, et on võimatu sünteesida elemente, mille aatomnumber ületab Lawrence'i 103 aatomarvu.
(E) Rutherfordiumi sünteesi ajal seatakse selle rühma kergemad elemendid keemiliselt esikohale.
Vasta: täht B
Transaktiniidielemendid, nagu Rf, on radioaktiivsed ja lagunevad spontaanselt suurel kiirusel, kuna nende poolestusaeg on lühike. Seega on katse lõpuks sünteetilisest liigist järele jäänud vähe aatomeid.
küsimus 2
1964. aastal väitsid Dubna teadlased, et nad sünteesisid rutherfordiumi isotoobi-260 (Z = 104). Kui palju on selle isotoobi puhul neutroneid?
(A) 104
(B) 260
(C) 151
(D) 156
(E) 161
Vasta: täht D
Arv neutronid (n) saab arvutada massiarvu (A) ja aatomarvu (Z) abil järgmise võrrandi abil:
A = Z + n
Asendades on meil:
260 = 104 + n
n = 260-104
n = 156
pildi tiitrid
[1] roseed abbas / shutterstock
Autor Stefano Araújo Novais
Keemia õpetaja
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/rutherfordio-rf.htm