THE seaborgium, sümbol Sg ja aatomnumber 106, on sünteetiline keemiline element, mis asub perioodilise tabeli 6. rühmas. Selle avastus pärineb 1974. aastast, selle krediteeris Albert Ghiorso juhitud Ameerika rühmitus ja mille panuse andis Glenn Seaborg, kelle nimi sai alguse terminist seaborgium. Nagu paljud selle piirkonna elemendid Perioodilisustabel, sai seaborgiumi nimi ametlikuks alles 1997. aastal teadlaste rühmade vaheliste vaidluste ja läbirääkimiste tõttu.
Kuigi on uurijaid, kes on pühendunud selle uurimisele, on seaborgiumil vähe praktilist kasu. Selle põhjuseks on selle elemendi isotoopide sünteesimise raskused ja nende madal stabiilsus. Näiteks seaborgiumi stabiilsema isotoobi poolestusaeg on ligikaudu viis minutit.
Vaata ka: Dubnium — teine sünteetiline keemiline element perioodilise tabeli 6. rühmas
Kokkuvõte seaborgiumi kohta
- See on sünteetiline keemiline element, mis asub perioodilise tabeli 6. rühmas.
- Selle sünteesisid esmakordselt 1974. aastal kaks erinevat rühma.
- See on radioaktiivne element.
- Seaborgiumi kohta pole veel palju teada, kuna stabiilseid proove toodetakse harva märkimisväärsetes kogustes.
- Seaborgiumiks sai element ametlikuks alles 1997. aastal teadlase Glenn Seaborgi auks.
Ära nüüd lõpeta... Pärast kuulutust on rohkem ;)
Seaborgiumi omadused
- Sümbol: Sg.
- Aatomnumber: 106.
- Aatommass: 269 c.u.
- Elektrooniline konfiguratsioon: [Rn] 7s2 5f14 6d4.
- Tuntumad isotoobid: 269Sg (poolväärtusaeg 5 ± 3 minutit); 271Sg (poolväärtusaeg 3,1 ± 1,6 minutit).
- Keemiline seeria: rühm 6; transaktiniidid; ülirasked elemendid.
Seaborgiumi omadused
Transaktiniidielementidele on iseloomulik olla radioaktiivne olek.. Need on elemendid, mille aatomnumber on suurem või võrdne 104 (ruterfordiumist, Rf). Neid elemente otsiti aga loodusest ohjeldamatult ja teoretiseeriti "stabiilsuse saare" kohta.

See esindaks ülirasket aatomipiirkonda, milles arv prootonid oleks keskmiselt 114 ja elementidel oleks suurepärane pool elu (aeg, mis kulub proovi massi vähenemiseks poole võrra), näidates end elujõulise ja eksperimentaalsete uuringute jaoks kättesaadavana.
Nende looduslike jälgede leidmiseks on aga alates 1950. aastatest tehtud mitmeid jõupingutusi 1980. aastate keskel ütlesid Georgi Flerov ja Gurgen Ter-Akopian, et neil pole lootustki neid maailmast leida. loodus.
Nagu ka teiste transaktiniidide elementide puhul, on seaborgiumi laiapõhjaline uurimine keeruline. Seda sellepärast, on võimalik ainult sünteesidaväikestes kogustes, millel onväga lühike poolestusaeg, see tähendab, et neid on vähe aatomid ja need püsivad paar minutit.
See võimaldas kinnitada, et seaborgium on tegelikult 6. rühmast, nagu see oli ühendi SgO puhul2cl2, mis teatud mõttes meenutas rühma stabiilsete elementide analoogseid ühendeid, nagu WO2cl2 ja MoO2cl2.
Loe ka:Transuraanelemendid - tehiselemendid, mis tulevad perioodilises tabelis pärast uraani
Seaborgiumi saamine
Kuna seaborgium on sünteetiline element, on oluline märkida, et seda looduses ei leidu. Seaborgiumi saamisel takistab lisaks asjaolule, et seda on võimalik sünteesida vaid väikeses koguses, see, et selle saamiseks on vaja kõrgtehnoloogilisi masinaid ja ekstreemseid tingimusi.
Aatomid, nagu seaborgium, tekivad reaktsioonil Fusioon kergemaid aatomeid kasutades ioonsed kiired väga kõrge energiaga ja on saadaval ainult uurimiseks keskkondades, mida peetakse enamiku keemiliste süsteemide suhtes vaenulikuks: kasutades kiirt plasma indutseeritud suurtes osakeste kiirendites.

Ajalooliselt sünteesiti seaborgium kokkupõrke kaudu ioonid18(hapnik-18), millel on 249Vrd sihtmärgina (californium-249). Seega kinnitati alfaosakeste lagunemise analüüsi abil elemendi 106 süntees.
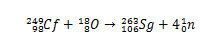
Ettevaatusabinõud seoses Seaborgiumiga
Keemilised elemendid, nagu seaborgium, ei kujuta endast suuri riske, kuna seda elementi ei toodeta piisavalt palju, et see püsiks pikka aega stabiilsena. Kogu hooldus, mida tuleb võtta, on seotud radioaktiivsed proovid, mida on võimalik tekitada ioniseeriv kiirgus lagunemisprotsessides.
Tea rohkem: Tšernobõli avarii – ajaloo suurim tuumaõnnetus
seaborgiumi ajalugu
Nagu teisedki ülirasked elemendid, on ka seaborgium avastati nn üleminekusõja kontekstis, tükike Külm sõda aasta ajaloos Keemia ja perioodilisustabel.
See sõda oli vaidlus nime eelistamise üle keemilised elemendid avastati pärast fermiumi (Fm, Z = 100), täpsemalt elementide aatomnumbritega 104 kuni 109 vahel, mis tekkisid külma sõja perioodil.
Selles vaidluses konkureerisid laborid:
- Dubna tuumauuringute ühisinstituut (endine osa Nõukogude Liit);
- Lawrence Berkeley riiklik labor California ülikoolis Berkeleys (Ühendriigid);
- Gesellschaft für Schwerionenforschung, Darmstadt (Saksamaa).
Täpsemalt seaborgiumi puhul tekkis vaidlus Dubna ja Berkeley laborite vahel. Seda seetõttu, et 1974. aastal väitsid mõlemad laborid, et neil õnnestus sünteesida element 106.
Kuid ühisaruanne, mis sisaldas liikmeid nii Rahvusvahelisest Puhta- ja Rakenduskeemia Liidust (IUPAC) kui ka 1993. aastal tehtud puhta ja rakendusfüüsika (Iupap) uurimus jõudis järeldusele, et kuigi see on tulevaste arengute jaoks väga oluline, sina Dubna laborites tehtud katsed ei näidanud elemendi 106 moodustumist veenvalt, tunnustades seega Berkeley Laboratories'i uue elemendi avastamise eest.
Iupaci anorgaaniliste ühendite nomenklatuurikomisjon (CNIC) pakkus teadlaste ettepanekuid eirates isegi elemendi 106 jaoks nime rutherfordium. Pärast pikka arutelu tegi Berkeley Labsi meeskond Albert Ghiorso juhtimisel otsustas nime osas austada kolleeg Glenn Theodore Seaborgi, PNobeli preemia keemias 1951. aastal, nimetades elemendi seaborgiumiks.
Tema poeg Eric Seaborg rääkis ühes artiklis isegi oma isa reaktsioonist sellele ideele:
Ghiorso lähenes meeskonnaliikmetele ükshaaval, kuni seitse neist noogutasid. Seejärel ütles ta oma 50-aastasele sõbrale ja kolleegile: "Meil on seitse häält elemendi 106 nimetamise poolt seaborgiumiks. Kas võtaksite vastu?" Mu isa oli üllatunud ja pärast emaga konsulteerimist nõustus.
Lahendas harjutusi seaborgiumi kohta
küsimus 1
Seaborgiumi isotoop massiga 269, mille hinnanguline poolestusaeg on 5 minutit. Selle sünteesikatses suutsid teadlased 25 minuti pärast tuvastada 0,0025 mg seaborgiumi isotoopi 269. Seaborgiumi esialgne mass oli:
A) 0,0025 mg
B) 0,0050 mg
C) 0,0100 mg
D) 0,0200 mg
E) 0,0800 mg
Resolutsioon:
Alternatiiv E
Poolväärtusaeg on aeg, mis kulub radioaktiivse proovi koguse vähenemiseks poole võrra. 25 minuti jooksul oli seaborgiumi poolväärtusaeg 5. Seega on võimalik teha tagasiulatuv analüüs:
- 0,0050 mg kuni 0,0025 mg (5. poolväärtusaeg)
- 0,0100 mg kuni 0,0050 mg (4. poolväärtusaeg)
- 0,0200 mg kuni 0,0100 mg (3. poolväärtusaeg)
- 0,0400 mg kuni 0,0200 mg (2. poolväärtusaeg)
- 0,0800 mg kuni 0,0400 mg (1. poolväärtusaeg)
küsimus 2
1974. aastal õnnestus Californias Berkeleys Albert Ghiorso juhitud rühmal sünteesida element 106, tuntud ülekandesõja ajal, mis oli osa keemia ajaloos külmast sõjast. Selle uue elemendi massiarv oli lisaks aatomnumbrile 106 ka 263. 1997. aastal muudeti ta ametlikuks seaborgiumiks, viidates Ghiorso sõbrale ja kolleegile Glenn Seaborgile, Nobeli keemiaauhinna laureaat 1951. aastal ja samuti selle rühma liige, kes suutis sünteesida uue element.
Esitatud andmete põhjal on võimalik järeldada, et neutronite arv sünteesitud seaborgiumis on võrdne:
A) 155
B) 157
C) 159
D) 106
E) 263
Resolutsioon:
Alternatiiv B
Arv neutronid Aatomi arvu saab arvutada järgmiselt:
A = Z + n
A on arv pasta, Z on aatomarv ja n on neutronite arv.
Asendades küsimuses esitatud andmed, saame:
263 = 106 + n
n = 157
Autor Stefano Araújo Novais
Keemia õpetaja



