THE pastaaatomi, nagu nimigi ütleb, on see aatomi mass, mida tavaliselt sümboliseerib "mThe” või „MA”. Kuna aatom on aga äärmiselt väike, inimsilmale nähtamatu üksus, ei ole võimalik selle massi näiteks kaalude abil mõõta. Nii määrasid teadlased aatomite massi, võrreldes neid teiste aatomite massidega.
Seda tehakse ka teiste üksustega. Näiteks on massiühikuks standardkilogramm, mis vastab 3,917 cm kõrguse ja läbimõõduga silindrile, mis on valmistatud 10% iriidiumist ja 90% plaatinast. Nii et see toimib võrdlusena. Näiteks kui me “kaalame” objekti skaalal ja leiame, et selle mass on 10 kg, tähendab see, et selle mass on 10 korda suurem kui valitud standard: 1 kg.
Sama kehtib ka aatomite kohta. Standardiks valiti süsinik-12 ja selle aatomi massiks määrati meelevaldselt 12 u. "u" on aatommassi ühik ja võrdub seega 1/12 süsinikuaatomi massiga.
Näiteks kui me ütleme, et vesiniku aatommass on 1 u, tähendab see, et see on justkui kui jagame süsiniku 12 osaks, on ühe osa mass võrdne aatomi aatomi massiga. vesinik. Teine näide on väävel, selle aatommass on 32 u, mis tähendab, et selle mass on 32 korda suurem kui 1/12
12Ç.1 u = 1/12 1 süsinikuaatomi massist 12

Aatommassi ühik on 1/12 süsinik-12 massist
Ainete molekulmass on elementide aatommasside summa. Näiteks hapniku aatommass võrdub 16 u, seega hapnikugaasi molekuli molekulmass (O2) võrdub 32u.
Kuna laboritehnikad on praegu väga arenenud, on olemas seadmeid, mis mõõdavad täpselt elementide aatommassi, näiteks massispektromeeter. Seega on võimalik seda teada 1 u võrdub 1,66054. 10-24 g.
Mõttekaart: aatommass

*Mõttekaardi allalaadimiseks PDF-vormingus Kliki siia!
Kuna aatommassid määratakse suure täpsusega, esitatakse need perioodilisuse tabelis kümnendarvude kujul. Kuid kui me läheme arvutusi tegema, kasutame tavaliselt ümardatud arvu, välja arvatud katsed, mis peavad olema väga täpsed. Näiteks kui vaatate perioodilist tabelit, näete, et hapniku aatommass on 15 999 u, kuid üldiselt kasutame arvutustes väärtust 16 u. See juhtub ka süsinikuga, mille aatommass on 12,01 u, nagu on näidatud allpool:
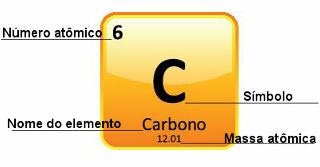
Süsiniku kujutamine perioodilises tabelis
Perioodilises tabelis olevad elemendid on tegelikult kõigi elemendi looduslike isotoopide kaalutud keskmised. Seega on tabelis kuvatav aatommass ka nende elementide aatommasside keskmine. Näiteks klooril (C?) on kaks looduslikku isotoopi, 35 ja 37, mille vastavad protsendid looduses on 75,76% ja 24,24%. Kõigi nende isotoopide aatommassid on erinevad, kusjuures Cp-35 oma on 34,96885 u ja Cp-37 aatommass on 36,96590.
Sel viisil arvutatakse elemendi aatommass, võttes arvesse iga isotoobi massi ja arvukust, millega see looduses esineb. Kloori puhul on meil:
Kloor elemendi aatommass = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Kloor elemendi aatommass = 35,45
See on kloori aatommassi väärtus, mis kuvatakse perioodilises tabelis.
* Minu Diogo Lopesi mõttekaart
Autor Jennifer Fogaça
Lõpetanud kirjas
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
