Redoksreaktsioonide peamine eristav tunnus seisneb selles, et samaaegselt kaotab üks keemiline liik elektrone (oksüdeerides) ja teine võib juurde elektrone (redutseerimisel).
Teatud reaktsioonides on siiski võimalik täheldada, et tegemist ei ole ainult oksüdatsiooni ja/või redutseerimisega. Allpool on näide:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Arvutades selle reaktsiooni kõigi aatomite oksüdatsiooniarvud (Nox), nagu on kirjeldatud tekstis "Oksüdatsiooniarvu (Nox) määramine", on meil:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Vaatame nüüd, millisedainete Nox muutusi ja sellest tulenevalt oksüdeerusid ja redutseerisid:
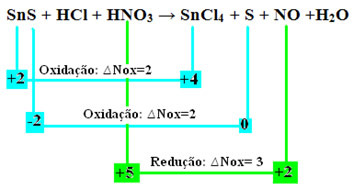
Pange tähele, et on toimunud kaks oksüdatsiooni. Niisiis, kuidas sellisel juhul keemilist võrrandit tasakaalustada?
Üks oluline asi, mida meeles pidada, mis kehtib kõigi redoksreaktsioonide kohta, on see ära antud elektronide arv peab alati võrduma vastuvõetud elektronide arvuga.
Seetõttu järgige seda tüüpi reaktsiooni tasakaalustamiseks samu reegleid, mis on sätestatud tekstis "
Redoksi tasakaalustamine”, kuid ainult ühe muudatusega: Kahe oksüdatsiooni (SnS) tekitanud liikide Nox variatsiooni (∆Nox) määramine on kahe ∆Nox summa, mis annab meile kadunud elektronide koguväärtuse:- SnS: ∆Total Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆NOx koguhulk = 2 + 2 = 4
- HNO3: ∆Nox = 3
Seega võime tasakaalustamiseks jätkata järgmiste sammudega:
- SnS: ∆NOx kokku = 4 → 4 on HNO koefitsient3;
- HNO3: ∆Nox = 3 → 3 on SnS koefitsient.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NO + H2O
Proovimeetodil tasakaalustamise jätkamine:
- Kuna teil on 1. liikmes 3 Sn ja 3 S, on need ka teie koefitsiendid 2. liikmes:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+EI+H2O
- Sellega jäi 2. liikmele 12 Cl (3. 4 = 12), seega on 12 aine koefitsient, mille esimeses liikmes, milleks on HCl, leidub Cl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO + H2O
- Nüüd on meil 1. liikmes 16 H (12 + 4 = 16), seega ka koefitsient H2O võrdub 8-ga, sest 8 korrutatuna vesinikuindeksiga, mis on 2, annab 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8H2O
- Lisaks on 1. liikmes ka 4 N, seega 4 on ka N koefitsient 2. liikmes:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2O
Pange tähele, et hapniku kogus 1. jäsemes (3. 4 = 12) võrdub selle elemendi koguhulgaga 2. jäsemes (4 + 8 = 12). Nii et reaktsioon on tasakaalus.
Autor Jennifer Fogaça
Lõpetanud keemia eriala
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm
