Orgaaniline keemia on lai keemiavaldkond, mis uurib süsinikuühendeid.
Orgaanilise keemia teadmistele lähenetakse mitmel viisil ja sellele mõeldes oleme teile teadmiste proovilepanekuks kokku pannud pakutavad harjutused, sisseastumiseksamid ja vaenlase küsimused.
Kasutage ka resolutsiooni kommentaare, et teema kohta veelgi rohkem teada saada.
Kavandatud harjutused
küsimus 1
Vaadake allpool olevaid orgaanilisi ühendeid ja tuvastage orgaanilised funktsioonid vastavalt esile tõstetud funktsionaalsetele rühmadele. Pärast seda nimetage ained.
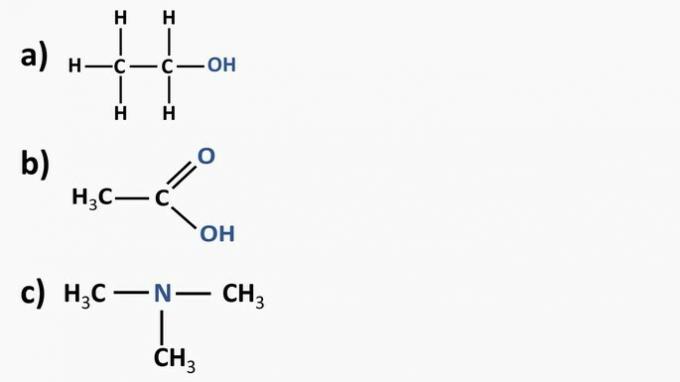
Vastus:
a) Orgaaniline ühend: etanool
- orgaaniline funktsioon: alkohol
- Üldvalem: R — OH
- Identifitseerimine: süsinikuahelaga seotud hüdroksüül (OH)
b) Orgaaniline ühend: etaanhape.
- Orgaaniline funktsioon: karboksüülhape
- Üldvalem: R — COOH
- Identifitseerimine: süsinikuahelaga seotud karboksüülrühm (COOH)
c) Orgaaniline ühend: trimetüülamiin
- Orgaaniline funktsioon: amiin (tertsiaarne)
- Üldvalem:
- Identifitseerimine: lämmastik on seotud kolme süsinikuahelaga
2. küsimus
Orgaanilises keemias tunnevad ühendid süsiniku ja vesiniku moodustatud ahelad ära. Kuid nende ühendite keemilises struktuuris võivad olla ka muud elemendid, näiteks hapnik.
Valige alternatiiv, kus kahel orgaanilisel ühendil on hapnikuga orgaanilised funktsioonid.
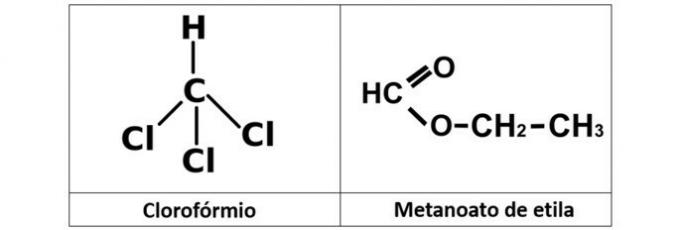
a) kloroform ja etüülmetanaat
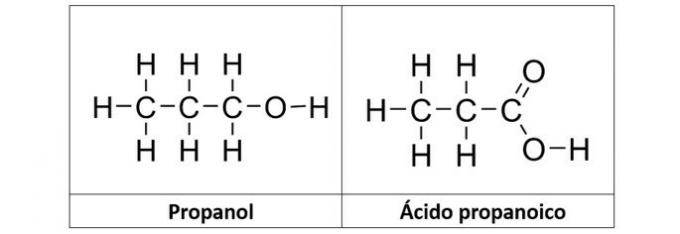
b) propanool ja propaanhape
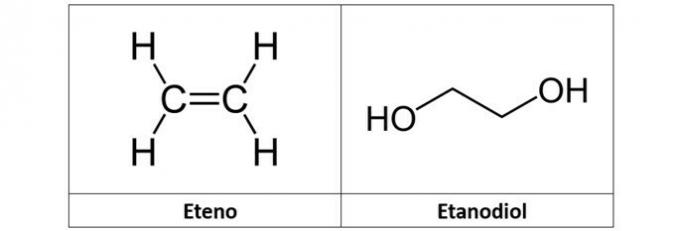
c) eteen ja etandiool
d) etaanamiid ja benseen
Õige vastus: b) propanool ja propaanhape
a) VALE. Meil on kloroform (CHCl3), mis on alküülhalogeniid, ja etüülmetanoanaester (C3H6O2), mis sisaldab oma struktuuris hapnikku.
b) ÕIGE. Selle alternatiivina on meil kaks ühendit, millel on hapnikuga orgaanilised funktsioonid. Propanool (C3H8O) on alkohol, mis moodustub kolmest süsinikust. Propaanhape (C3H6O2) on karboksüülhape.
c) VALE. Etüleen (C2H4), mida nimetatakse ka etüleeniks, on alkeen-tüüpi süsivesinikud. Juba etaandiool (C2H6O2) on alkohol, mille struktuuris on kaks hüdroksüülrühma.
d) VALE. Etaanamiid (C2H5NO) on amiid ja benseen on aromaatne süsivesinik ja seetõttu moodustub ainult süsinikust ja vesinikust.

3. küsimus
Vaadake allpool oleva orgaanilise ühendi struktuuri ja kontrollige tõeseid väiteid.

(01) Ühendil on orgaanilise lämmastiku funktsioon.
(02) See on primaarne amiin, kuna see on seotud ainult ühe vesinikuga.
(03) Ühendi nimi on dietüülamiin.
Õige vastus:
(01) ÕIGE. Orgaanilise lämmastiku funktsioon ühendis on amiin.
(02) VALE. See on sekundaarne amiin, kuna lämmastik on seotud kahe süsinikuahelaga.
(03) VALE. Ühendi nimi on dimetüülamiin, kuna lämmastikuga on seotud kaks metüülradikaali.
4. küsimus
Fenüülpropanoidide perekonda kuuluv eugenool on aromaatne orgaaniline ühend nelkides, mis on kasutatud iidsetest aegadest.

Jälgige ühendi struktuurivalemit ja tuvastage olemasolevad orgaanilised funktsioonid.
a) Alkohol ja eeter
b) fenool ja eeter
c) Alkohol ja ester
d) fenool ja ester
e) Alkohol ja süsivesinikud
Õige alternatiiv: b) fenool ja eeter.
Eugenooli ahelas on hapnikuga rikastatud orgaanilised funktsioonid, see tähendab, et lisaks süsiniku- ja vesinikuaatomitele on hapnik heteroaatom.
Orgaanilist fenoolfunktsiooni iseloomustab hüdroksüül (-OH), mis on kinnitatud aromaatsele ringile. Eetri funktsioonis paikneb hapnik kahe süsinikuahela vahel.
5. küsimus
EDTA, täisnimega etüleendiamiintetraäädikhape, on paljude rakendustega orgaaniline ühend. Selle võime siduda metalliioone muudab selle kelaativateks aineteks, mida kasutatakse laialdaselt nii laboris kui ka tööstuslikult.
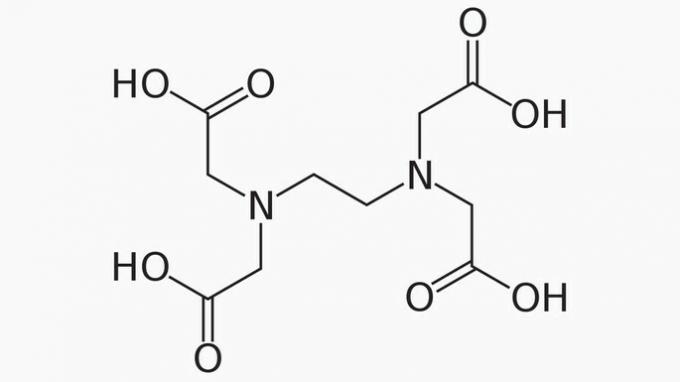
EDTA kohta on õige öelda, et süsinikuahel on:
a) avatud, homogeenne ja küllastumata.
b) suletud, heterogeenne ja küllastunud.
c) avatud, heterogeenne ja küllastumata.
d) suletud, homogeenne ja küllastunud.
e) avatud, heterogeenne ja küllastunud.
Õige vastus: e) avatud, heterogeenne ja küllastunud.
EDTA kett on liigitatud:
AVATUD. Vastavalt süsinikuaatomite paigutusele EDTA struktuuris näeme, et otste olemasolu tõttu on ühendi ahel avatud.
HETEROGEENNE. Lisaks süsiniku- ja vesinikuühenditele on süsinikuahelal lämmastiku ja hapniku heteroaatomid.
RAHULIK. Süsinikuaatomite vahelised sidemed on küllastunud, kuna ahelal on ainult üksiksidemed.
Lisateave aadressil: Orgaaniline keemia.
sisseastumiseksami küsimused
küsimus 1
(UFSC) Jälgige puudulikke orgaanilisi struktuure ja tuvastage õige (d) üksus (ed):
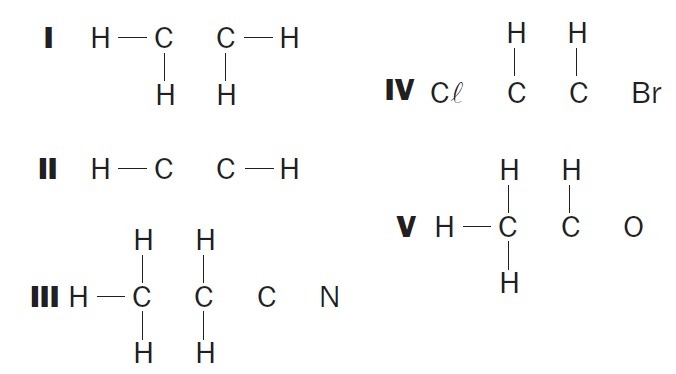
(01) I struktuuril puudub süsinikuaatomite vahel üks side.
(02) II struktuuril puudub süsinikuaatomite vahel kolmikside.
(03) III struktuuris puudub süsinikuaatomite vahel kaks üksiksidet ning süsiniku- ja lämmastikuaatomite vahel kolmekordne side.
(04) IV struktuuris puudub kaks üksiksidet süsinikuaatomite ja halogeenide vahel ning kaksikside süsinikuaatomite vahel.
(05) Struktuuril V puudub süsinikuaatomite ja süsiniku- ja hapnikuaatomite üksikside.
Õiged alternatiivid: 02, 03 ja 04.
Lisaks süsinikule, mis on orgaaniliste ühendite kohustuslik keemiline element, võivad struktuurides esineda ka muud elemendid ja need on seotud kovalentsete sidemetega, kus elektronid on ühised.
Elementide valents määrab moodustatavate sidemete arvu, nagu on näidatud allolevas tabelis.
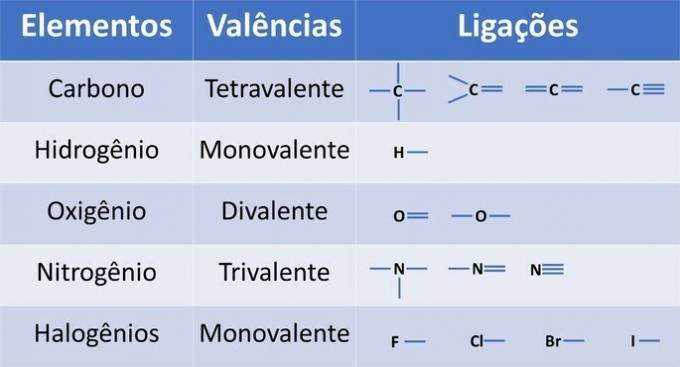
Selle teabe põhjal on meil:
(01) VALE. Struktuuril puudub eteeniühendi moodustamiseks süsinikuaatomite vahel kaksikside.
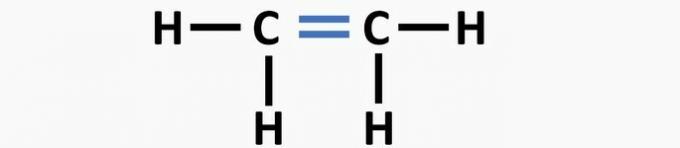
(02) ÕIGE. Struktuuril puudub süsinikuaatomite vahel kolmekordne side etüüniühendi moodustamiseks.
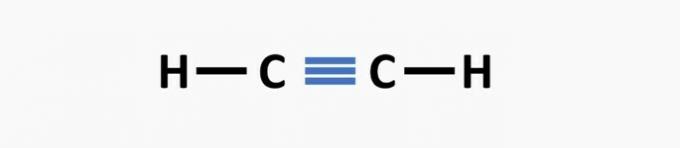
(03) ÕIGE. Struktuuril puuduvad üksikud sidemed süsinike vahel ja kolmiksidemed süsiniku ja lämmastiku vahel, et moodustada ühend propanenitriil.
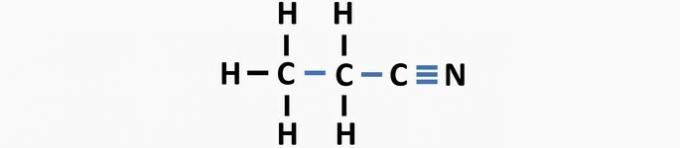
(04) ÕIGE. Struktuuril puudub dikloroeteeni ühendi moodustamiseks üksikside süsiniku ja halogeeni vahel ning kaksiksidemed süsinike vahel.
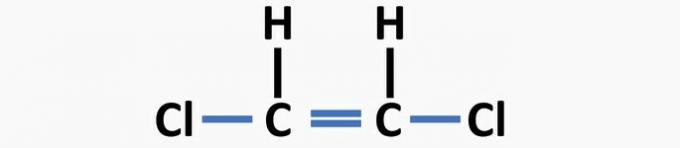
(05) VALE. Struktuuril puudub etanaali ühendi moodustamiseks süsinike ja süsiniku ja hapniku vahel kaksikside.
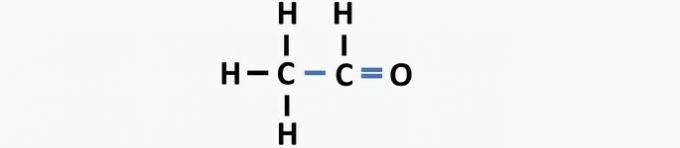
2. küsimus
(UFPB) Molekulaarse valemi C orgaanilise ühendi struktuur5H8Hargnenud, küllastumata, heterogeenne ja alitsükliline ahel on järgmine:

Õige alternatiiv: d.
Süsinikahelad võib liigitada järgmiselt:
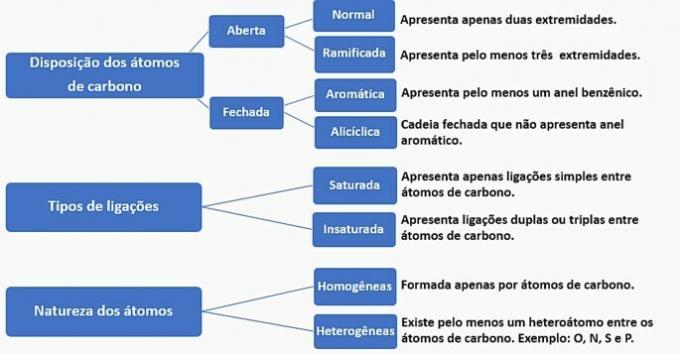
Selle teabe kohaselt on meil:
a) VALE. Ahel on klassifitseeritud normaalseks, küllastunud, homogeenseks ja alitsükliliseks.
b) VALE. Kett on klassifitseeritud normaalseks, küllastumata, homogeenseks ja avatud.
c) VALE. Kett on klassifitseeritud hargnenud, küllastumata, homogeenseks ja avatud.
d) ÕIGE. Ahel on klassifitseeritud hargnenud, küllastumata, heterogeenseks ja alitsükliliseks, nagu
- Sellel on haru: metüülradikaal;
- Omab küllastumatust: kaksikside süsinike vahel;
- Sellel on heteroaatom: hapnik, mis on seotud kahe süsinikuga;
- Sellel on suletud ahel: süsinikud, mis on ringis ühendatud ilma aromaatse tsüklita.
e) VALE. Kett on klassifitseeritud hargnenud, küllastumata, heterogeenseks ja avatud.
3. küsimus
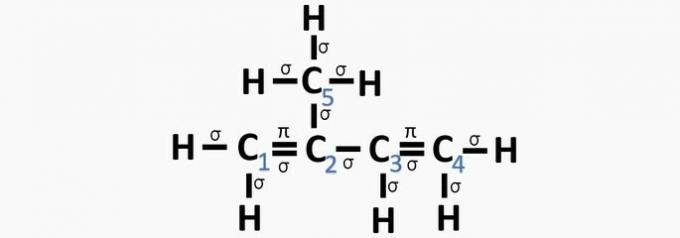
(Centec-BA) Allpool toodud struktuuris on nummerdatud süsinikud vastavalt:
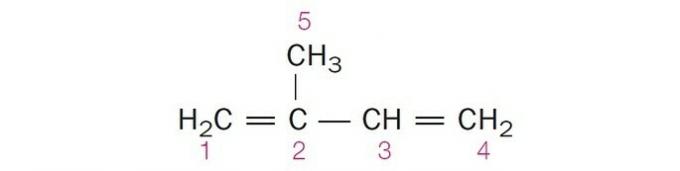
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Õige alternatiiv: c) sp2, sp2, sp2, sp2, sp3.
Kuna selle valentskoores on 4 elektroni, on süsinik neljavalentne, st tal on kalduvus moodustada 4 kovalentset sidet. Need võlakirjad võivad olla ühe-, kahe- või kolmekordsed.
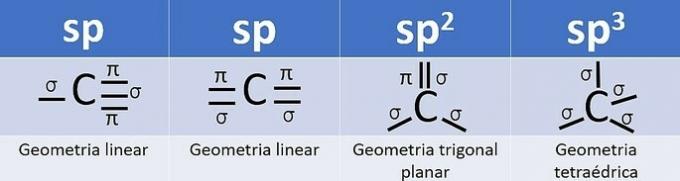
Hübriidorbitaalide arv on süsiniku sigmasidemete (σ) summa alates sidemest ei hübridiseeru.
- sp: 2 sigmalinki
- sp2: 3 sigmalinki
- sp3: 4 sigmalinki
Selle teabe kohaselt on meil:
a) VALE. Süsinik 2 on sp hübridiseerunud2, kuna sellel on 3 σ sidet ja üks side .
b) VALE. Süsinikul pole sp hübridiseerumist4 ja sp hübridisatsioon toimub siis, kui süsinike vahel on kolmikside või kaks kaksiksidet.
c) ÕIGE. Iga süsiniku σ sidemete summa annab alternatiivse hübridisatsiooni.
d) VALE. Sp hübridisatsioon toimub siis, kui süsinike vahel on kolmekordne side või kaks kaksiksidet.
e) VALE. Süsinikul pole sp hübridiseerumist4 ja sp hübridisatsioon toimub siis, kui süsinike vahel on kolmikside või kaks kaksiksidet.
4. küsimus
(UFF) On gaasiline proov, mis on moodustatud ühest järgmistest ühenditest: CH4; Ç2H4; Ç2H6; Ç3H6 või C3H8. Kui 22 g sellest proovist hõivab 24,6 l mahu rõhul 0,5 atm ja temperatuuril 27 ° C (antud: R = 0,082 L .atm. K–1.mol–1) järeldatakse, et see on gaas:
a) etaan.
b) metaan.
c) propaan.
d) propeen.
e) eteen.
Õige alternatiiv: c) propaan.
1. samm: teisendage temperatuuriühik Celsiuse järgi Kelviniks.
2. etapp: arvutage ühendi moolide arv, kasutades üldist gaasivõrrandit.
3. samm: arvutage ühendi molaarmass.
4. samm: leidke süsivesinik, mille molaarmass on 44 g / mol.
Metaan
Eteen
Etaan
propüleen
Propaan
Seega järeldatakse, et avalduses sisalduvale teabele vastav gaas on propaan.
5. küsimus
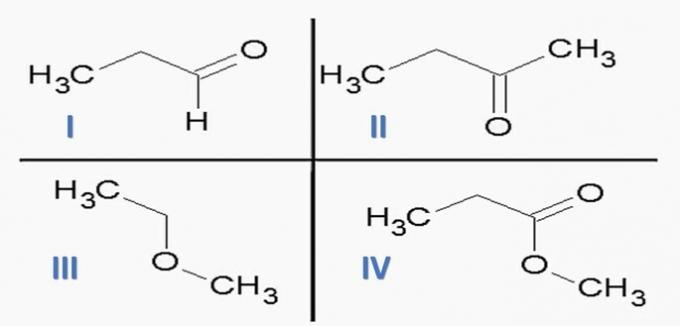
(ITA) kaaluge järgmisi aineid:
ja järgmised keemilised funktsioonid:
The. karboksüülhape;
B. alkohol;
ç. aldehüüd;
d. ketoon;
ja. ester;
f. eeter.
Võimalus seostada aineid ÕIGE keemiliste funktsioonidega on:
abi; IIc; IIIe; IVf.
b) Ic; IId; IIIe; Käibemaks
c) Ic; IId; IIIf; IVe.
d) Id; IIc; IIIf; IVe.
e) la; IIc; IIIe; IVd.
Õige alternatiiv: c) Ic; IId; IIIf; IVe.
Orgaanilised funktsioonid määratakse sarnaste omadustega orgaaniliste ühendite struktuuride ja rühmade järgi.
Alternatiivide keemilised funktsioonid on järgmised:
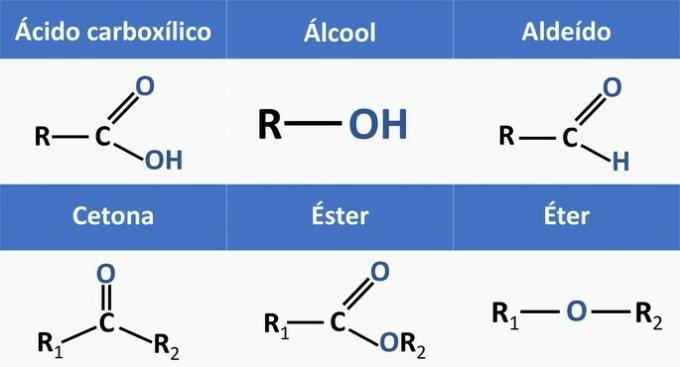
Analüüsides ülaltoodud struktuure ja avaldises sisalduvaid ühendeid, on meil:
a) VALE. Elundi funktsioonid on õiged, kuid järjestus vale.
b) VALE. Ühendite hulgas ei ole karboksüülhapet.
c) ÕIGE. Ühendites esinevad funktsionaalsed rühmad esindavad järgmisi keemilisi funktsioone.

d) VALE. I on aldehüüd ja II on ketoon.
e) VALE. Ühendite hulgas ei ole karboksüülhapet.
Lisateave aadressil: Orgaanilised funktsioonid.
Vaenlaste küsimused
küsimus 1
(Enem / 2014) Üks bensiini etanoolisisalduse määramise meetod seisneb teadaolevate vee- ja bensiinikoguste segamises konkreetses pudelis. Pärast kolvi raputamist ja teatud aja ootamist mõõdetakse saadud kahe segunemata faasi mahud: üks orgaaniline ja teine vesilahus. Kunagi bensiiniga segunev etanool seguneb nüüd veega.
Etanooli käitumise selgitamiseks enne ja pärast vee lisamist on vaja teada
a) vedelike tihedus.
b) molekulide suurus.
c) vedelike keemistemperatuur.
d) molekulides esinevad aatomid.
e) molekulide vastastikuse mõju tüüp.
Õige alternatiiv: e) molekulide vastastikuse mõju tüüp.
Molekulidevahelised jõud mõjutavad orgaaniliste ühendite lahustuvust. Ained kipuvad üksteisega lahustuma, kui neil on sama molekulidevaheline jõud.
Alljärgnevast tabelist leiate mõned näited orgaanilistest funktsioonidest ja molekulide vastastikuse mõju tüübist.
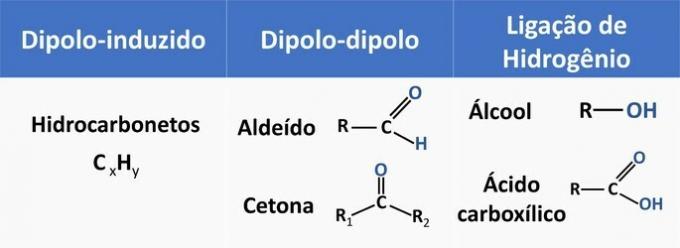
Etanooli peetakse polaarseks lahustiks, kuna selle struktuuris on polaarrühm (—OH). Kuid selle süsinikahel, olles mittepolaarne (CH), on võimeline interakteeruma mittepolaarsete lahustitega. Seetõttu lahustub etanool nii vees kui ka bensiinis.
Selle teabe kohaselt on meil:
a) VALE. Tihedus seob keha massi hõivatud ruumalaga.
b) VALE. Molekulide suurus mõjutab ühendite polaarsust: mida suurem on süsinikuahel, seda mittepolaarsemaks muutub aine.
c) VALE. Keemistemperatuur on molekulide eraldamiseks kasulik: destilleerimisel eraldatakse erineva keemistemperatuuriga ühendid. Mida madalam on keemistemperatuur, seda kergemini molekul aurustub.
d) VALE. Aldehüüdi struktuuris on süsinik, vesinik ja hapnik. See ühend toimib dipool-dipool koostoimes, samas kui samade elementidega alkohol on võimeline moodustama vesiniksidemeid.
e) ÕIGE. Etanooli vastastikmõju veega (vesinikside) on intensiivsem kui bensiiniga (diplo-indutseeritud).
2. küsimus
(Enem / 2013) Molekulid nanoputid need sarnanevad inimfiguuridega ja loodi selleks, et ergutada noorte huvi orgaanilises keemias laialdaselt kasutatavate struktuurivalemitega väljendatud keele mõistmise vastu. Näiteks on NanoKid, mida on kujutatud joonisel:
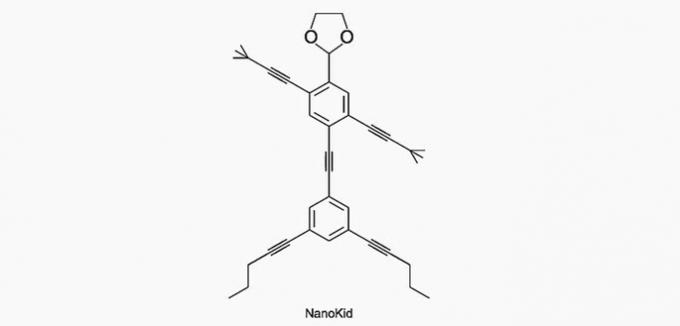
Kus NanoKidi kehas on kvaternaarne süsinik?
a) Käed.
b) Pea.
c) Rindkere.
d) kõht.
e) jalad.
Õige alternatiiv: a) käed.
Süsinik klassifitseeritakse järgmiselt:
- Esmane: seondub süsinikuga;
- Sekundaarne: seondub kahe süsinikuga;
- Tertsiaarne: seondub kolme süsinikuga;
- Kvaternaarne: seondub nelja süsinikuga.
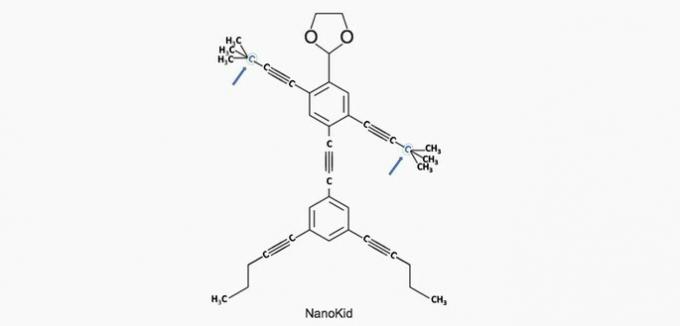
Vaadake allpool toodud näiteid.

Selle teabe kohaselt on meil:
a) ÕIGE. Käes olev süsinik on seotud veel nelja süsinikuga, seega on see kvaternaarne.
b) VALE. Pea koosneb primaarsetest süsinikest.
c) VALE. Rind koosneb sekundaarsetest ja tertsiaarsetest süsinikest.
d) VALE. Kõhu koosneb sekundaarsetest süsinikest.
e) VALE. Jalad on valmistatud primaarsetest süsinikest.
3. küsimus
(Enem / 2014) Mõnda polümeerset materjali ei saa kasutada ka teatud tüüpi esemete tootmiseks mehaaniliste omaduste piirangud, kas nende lagunemise kerguse tõttu, tekitades selleks soovimatuid kõrvalsaadusi rakendus. Seetõttu muutub eseme valmistamisel kasutatava polümeeri olemuse kindlakstegemiseks kontrollimine oluliseks. Üks võimalikest meetoditest põhineb polümeeri lagunemisel selle tekitanud monomeeride saamiseks.
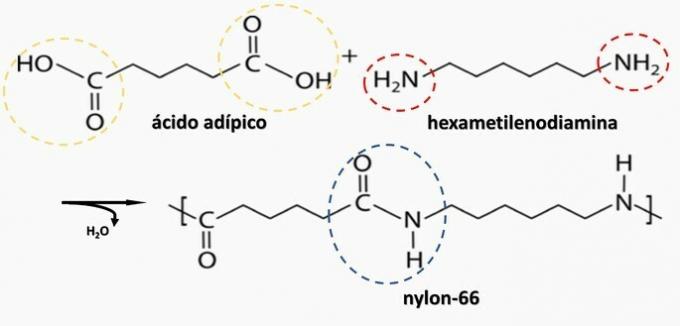
Artefakti kontrollitud lagunemine tekitas diamiin H2N (CH2)6NH2 ja HO dihape2C (CH2)4CO2H. Seetõttu tehti artefakt
a) polüester.
b) polüamiid.
c) polüetüleen.
d) polüakrülaat.
e) polüpropüleen.
Õige alternatiiv: b) polüamiid.
a) VALE. Polüester moodustub dikarboksüülhappe (-COOH) ja dialkohol (-OH) vahelises reaktsioonis.
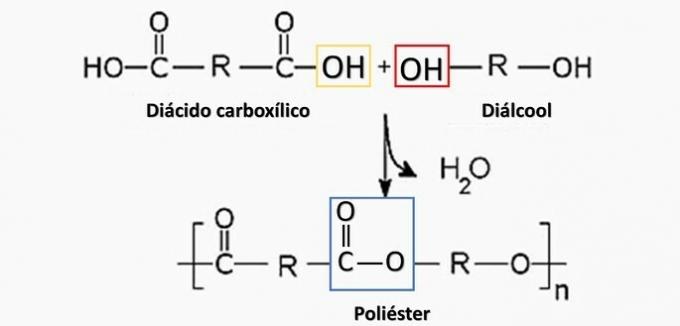
b) ÕIGE. Polüamiid moodustub dikarboksüülhappe (–COOH) polümeerimisel diamiiniga (—NH2).
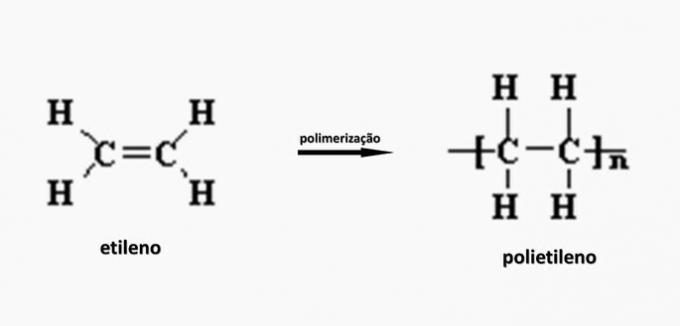
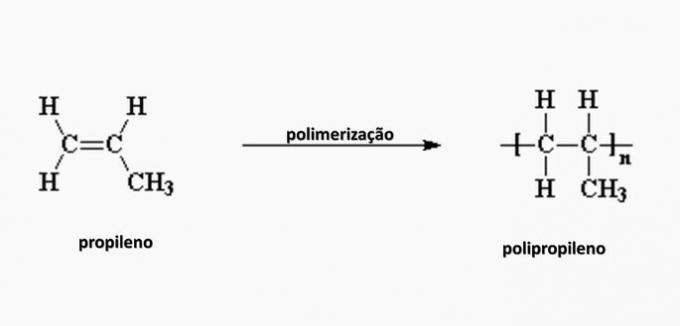
c) VALE. Polüetüleen moodustub etüleenmonomeeri polümerisatsioonis.
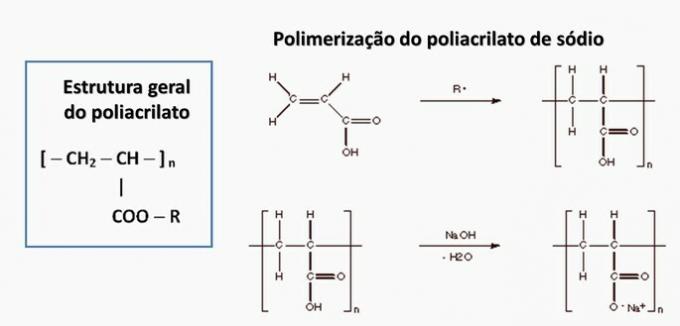
d) VALE. Polüakrülaat moodustub karboksüülhappest saadud soola abil.
e) VALE. Polüpropüleen moodustub propüleenmonomeeri polümerisatsioonis.
4. küsimus
(Enem / 2008) Hiina on lubanud hüvitada Venemaale tööstuse benseeni lekkimise Hiina naftakeemia Amuuri jõe lisajõe Songhua jões, mis moodustab osa nende kahe piirist riikides. Venemaa föderaalse veevarude ameti president kinnitas, et benseen ei jõua joogivett, kuid palus elanikkonnal voolavat vett keeta ja vältida kalapüüki Amuuri jões ja selle piirkonnas lisajõed. Kohalikud omavalitsused ladustavad sadu tonne kivisütt, kuna mineraali peetakse tõhusaks benseeni absorbeerijaks. Internet: (kohandustega). Võttes arvesse keskkonnale ja elanikkonnale tekitatud kahju minimeerimiseks võetud meetmeid, on õige seda väita
a) kivisüsi reageerib vette asetatuna benseeniga, kõrvaldades selle.
b) benseen on lenduvam kui vesi ja seetõttu tuleb seda keeta.
c) kalapüügi vältimise suund on tingitud kalade säilitamise vajadusest.
d) benseen ei saastaks joogiveetorusid, kuna see dekanteeritakse looduslikult jõe põhjas.
e) Hiina tööstuse benseeni leke põhjustatud reostus piirduks Songhua jõega.
Õige alternatiiv: b) benseen on lenduvam kui vesi ja seetõttu on vaja seda keeta.
a) VALE. Kivisüsi sisaldab oma struktuuris mitmeid poore ja seda kasutatakse adsorbendina, kuna see on võimeline saasteainetega suhtlema ja neid oma pinnal hoidma, kuid mitte neid kõrvaldama.
b) ÕIGE. Mida suurem on aine lenduvus, seda kergemini muutub see gaasiliseks olekuks. Kui vee keemistemperatuur on 100 ° C, siis benseeni temperatuur on 80,1 ° C. Seda seetõttu, et vesi on polaarne ühend ja benseen on mittepolaarne ühend.
Molekulide koostoime tüüp on erinev ja mõjutab ka ainete keemistemperatuuri. Veemolekul on võimeline looma vesiniksidemeid, mis on palju tugevam koostoime kui see, mida benseen koos indutseeritud dipooliga suudab tekitada.
c) VALE. Toiduahelas saab üks olend teise toiduks vastavalt liikide vastastikmõjudele asukohas. Mürgise aine keskkonda viimisel toimub järkjärguline akumuleerumine ja kalad saastunud võivad inimese poolt allaneelatuna kaasa võtta benseeni ja põhjustada DNA mutatsioone ja isegi isegi vähk.
d) VALE. Benseenil on väiksem tihedus kui vees. Seega on suundumus, et isegi vee all levib see jätkuvalt.
e) VALE. Hooajalised muutused võivad probleemi veelgi suurendada, kuna madal temperatuur vähendab päikese või bakterite toimel kemikaalide bioloogilist lagunemisvõimet.
5. küsimus
(Enem / 2019) Süsivesinikud on orgaanilised molekulid, millel on rida tööstuslikke rakendusi. Näiteks leidub neid suurtes kogustes erinevates naftafraktsioonides ja tavaliselt eraldatakse nende keemistemperatuuri põhjal fraktsioneeriva destilleerimisega. Tabelis on toodud peamised nafta destilleerimisel saadud fraktsioonid erinevatel temperatuurivahemikel.
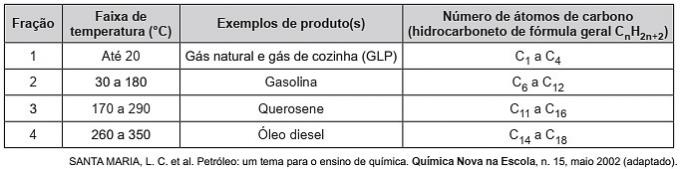
Fraktsioonis 4 toimub ühendite eraldamine kõrgematel temperatuuridel, kuna
a) nende tihedus on suurem.
b) harude arv on suurem.
c) selle lahustuvus õlis on suurem.
d) molekulidevahelised jõud on intensiivsemad.
e) süsinikuahelat on raskem murda.
Õige alternatiiv: d) molekulidevahelised jõud on intensiivsemad.
Süsivesinikud interakteeruvad indutseeritud dipooli abil ja seda tüüpi molekulidevaheline jõud süsinikuahela suurenemisega tugevneb.
Seetõttu on raskematel naftafraktsioonidel kõrgem keemistemperatuur, kuna ahelad toimivad indutseeritud dipooli abil tugevamalt.
Lisateavet kommenteeritud resolutsiooniga harjutuste kohta leiate ka:
- Harjutused süsivesinikega
- Orgaaniliste funktsioonide harjutused
- Keemia küsimused Enem