Kollektiivsed omadused hõlmavad uuringuid lahuste füüsikalised omadused, täpsemalt lahusti lahustunud aine juuresolekul.
Kuigi meie teada pole, kasutatakse kolligatiivseid omadusi laialdaselt tööstusprotsessides ja isegi erinevates igapäevastes olukordades.
Nende omadustega on seotud füüsilised konstandidnäiteks teatud ainete keemis- või sulamistemperatuur.
Näitena võime tuua autotööstuse protsessi, näiteks lisaainete lisamise autoradiaatoritele. See seletab, miks külmemates kohtades vesi radiaatoris ei külmuta.
Toiduga läbi viidud protsessid, näiteks liha või isegi suhkruga küllastunud toitude soolamine, hoiavad ära organismide riknemise ja paljunemise.
Lisaks nii vee magestamine (soola eemaldamine) kui ka kohati lume peale lume levitamine kus talv on väga karm, kinnitavad kolligatiivsete mõjude teadmise olulisust lahendusi.
Kas soovite rohkem teada saada kolligatiivsete omadustega seotud mõistete kohta? Loe artikleid:
- Vee füüsikalised olekud
- Sulamistemperatuur ja keemistemperatuur
- Vee magestamine
- Segude eraldamine
Lahusti ja lahusti
Kõigepealt peame pöörama tähelepanu mõistetele lahusti ja soluut, mõlemad lahuse komponendid:
- Lahusti: aine, mis lahustub.
- Soluut: lahustunud aine.
Näitena võime mõelda soolalahuse veega, kus vesi tähistab lahustit ja sool, soluut.
Kas soovite rohkem teada saada? Loe ka Lahustuvus.
Kollektiivsed mõjud: kollektiivsete omaduste tüübid
Kollektiivsed mõjud on seotud nähtustega, mis esinevad lahuse soluutide ja lahustite korral ning liigitatakse järgmiselt:
Tonometriline efekt
Tonoskoopia, mida nimetatakse ka tonometriaks, on nähtus, mida täheldatakse siis, kui vedeliku maksimaalse aururõhu langus (lahusti).
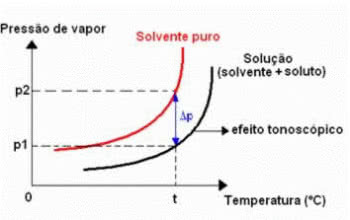
Tonometriline efektitabel
See toimub mittelenduva lahustunud aine lahustumisel. Seetõttu vähendab lahustunud aine lahusti aurustumisvõimet.
Seda tüüpi kolligatiivset mõju saab arvutada järgmise avaldise abil:
ΔP = lk0 - P
Kus
ΔP: maksimaalse aururõhu absoluutne langus lahuseni
P0: puhta vedeliku maksimaalne aururõhk temperatuuril t
P: lahuse maksimaalne aururõhk temperatuuril t
Ebuliomeetriline efekt
Ebulioskoopia, mida nimetatakse ka ebulliomeetriaks, on nähtus, mis aitab kaasa vedeliku temperatuuri kõikumise suurenemine keemise ajal.
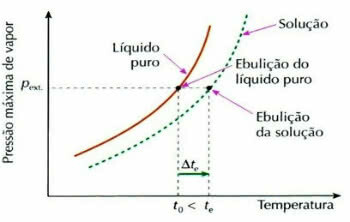
Ebuliomeetriline efekti graafik
See toimub mittelenduva lahustunud aine lahustumisel, näiteks kui lisame suhkrut keema hakkavale veele, tõuseb vedeliku keemistemperatuur.
Nn ebulliomeetriline (või ebuliskoopiline) efekt arvutatakse järgmise avaldise abil:
tja = tja - t0
Kus
tja: lahuse keemistemperatuuri tõus
tja: lahuse keemise algtemperatuur
t0: puhta vedeliku keemistemperatuur
Krüomeetriline efekt
Krüoskoopia, mida nimetatakse ka krüomeetriaks, on protsess, mille käigus külmumistemperatuuri languslahendus.
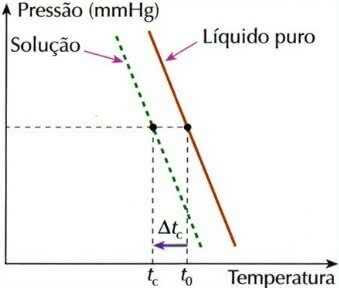
Krüomeetriline efekti graafik
Seda seetõttu, et kui mittelenduv lahustunud aine lahustatakse vedelikus, langeb vedeliku külmumistemperatuur.
Krüoskoopia näiteks on antifriisilisandid, mis asetatakse autoradiaatoritesse kohtades, kus temperatuur on väga madal. See protsess hoiab ära vee külmumise, aidates sellega kaasa mootorite elu.
Lisaks takistab tänavatele levinud sool kohtades, kus talv on väga külm, teedele jää kogunemist.
Selle kolligatiivse efekti arvutamiseks kasutatakse järgmist valemit:
tç = t0 - tç
Kus
tç: lahuse külmumistemperatuuri langetamine
t0: puhta lahusti külmumistemperatuur
tç: lahuse lahusti algne külmumistemperatuur
Vaadake selle atribuudiga eksperimenti aadressil: Keemia katsed
Raoulti seadus
Nn Raoult'i seaduse pakkus välja prantsuse keemik François-Marie Raoult (1830–1901).
Ta uuris kolligatiivseid mõjusid (tonometriline, ebuliomeetriline ja krüomeetriline), aidates kaasa keemiliste ainete molekulmasside uurimisele.
Uurides vee sulamise ja keetmisega seotud nähtusi, jõudis ta järeldusele, et 1 mooli mittelenduvate ja mitteioonsete lahustunud ainete sisaldus 1 kg lahustis, on teil alati sama tonometriline, ebuliomeetriline või krüomeetriline.
Seega saab Raoult'i seadust väljendada järgmiselt:
“Mittelenduvas ja mitteioonses lahustunud lahuses on kolligatiivne toime proportsionaalne lahuse molaalsusega.”.
Seda saab väljendada järgmiselt:
Plahendus = xlahusti. Ppuhas lahusti
Loe ka Molarv ja molaarmass.
osmomeetria
Osmomeetria on kolligatiivse omaduse tüüp, mis on seotud lahuste osmootne rõhk.
Pidage meeles, et osmoos on füüsikalis-keemiline protsess, mis hõlmab vee liikumist vähem kontsentreeritud (hüpotoonilisest) keskkonnast kontsentreeritumaks (hüpertooniliseks) keskkonnaks.
See toimub läbi poolläbilaskva membraani, mis võimaldab ainult vett läbida.
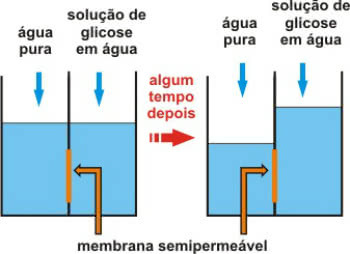
Mõne aja pärast poolläbilaskev membraanitoime
Kõne osmootne rõhk see on rõhk, mis laseb veel liikuda. Teisisõnu, see on lahusele avaldatav rõhk, mis takistab selle lahjendamist, juhtides puhta lahusti läbi poolläbilaskva membraani.
Seetõttu on osmomeetria osmootse rõhu uurimine ja mõõtmine lahustes.
Pange tähele, et vee magestamise tehnikas (soola eemaldamine) nimetatakse protsessi pöördosmoos.
Loe lähemalt Osmoos.
Osmomeetria seadused
Hollandi füüsik ja keemik Jacobus Henricus Van’t Hoff (1852-1911) vastutas kahe osmomeetriaga seotud seaduse postuleerimise eest.
Esimest seadust saab väljendada järgmiselt:
“Pideval temperatuuril on osmootne rõhk otseselt proportsionaalne lahuse molaarsusega.”
Tema poolt postuleeritud teises seaduses on meil järgmine väide:
“Pideva molaarsuse korral on osmootne rõhk otseselt proportsionaalne lahuse absoluutse temperatuuriga.”
Seetõttu kasutatakse molekulaarsete ja lahjendatud lahuste osmootse rõhu arvutamiseks valemit:
π = MRT
olemine,
π: lahuse osmootne rõhk (atm)
M: lahuse molaarsus (mol / l)
R: täiuslike gaaside universaalne konstant = 0,082 atm. L / mol. K
T: lahuse absoluutne temperatuur (K)
Loe ka Molaarsus.
Tagasisidega sisseastumiseksami harjutused
1. Võrreldes kahte panni, samaaegselt kahel identsel põletil samal ahjul, täheldatakse, et rõhk suletud survekatel keevas vees olevate gaaside sisaldus on suurem kui survekatla keevas vees avatud.
Sellises olukorras ja kui need sisaldavad täpselt sama kogust kõiki koostisosi, saame nentida, et võrreldes avatud pannil toimuvaga on küpsetusaeg kiirkeedus suletud on:
a) madalam, kuna keemistemperatuur on madalam.
b) madalam, kuna keemistemperatuur on kõrgem.
c) väiksem, kuna keemistemperatuur ei erine rõhust.
d) võrdne, kuna keemistemperatuur ei sõltu rõhust.
e) suurem, kuna rõhk on suurem.
B. Alternatiiv
2. (UFRN) Tõsistes talvistes kohtades on tavaks lisada autoradiaatorites vette teatud kogus etüleenglükooli. Lahuse kasutamine jahutusvedelikuna vee asemel on see, et lahusel on:
a) madalam sulamissoojus.
b) madalam külmumistemperatuur.
c) kõrgem külmumistemperatuur.
d) suurem sulamissoojus.
B. Alternatiiv
3. (Vunesp) Üks haavade ravimise viise on levinud arvamuse kohaselt neile suhkru- või kohvipulbri panemine. Kolligatiivset omadust, mis kõige paremini selgitab vedeliku eemaldamist kirjeldatud protseduuri abil, mis soodustab paranemist, uurib:
a) osmomeetria.
b) krüoskoopia.
c) endoskoopia.
d) tonoskoopia.
e) ebulliomeetria.
Alternatiiv
4. (UFMG) Sügavkülmas on jää- ja sidrunipopsi valmistamiseks viis erinevat vedelikku sisaldavat viisi. Kui vormid asetatakse sügavkülma samal ajal ja esialgu samal temperatuuril, külmutatakse kõigepealt 500 ml:
a) puhas vesi.
b) lahus vees, mis sisaldab 50 ml sidrunimahla.
c) lahus vees, mis sisaldab 100 ml sidrunimahla.
d) lahus vees, mis sisaldab 50 ml sidrunimahla ja 50 g suhkrut.
e) lahus vees, mis sisaldab 100 ml sidrunimahla ja 50 g suhkrut.
Alternatiiv
5. (Cesgranrio-RJ) Määrati aine x sulamistemperatuur, leides selle aine tabelist madalama väärtuse. See võib tähendada, et:
a) määramisel kasutatud aine kogus oli vajalikust väiksem.
b) määramisel kasutatud aine kogus oli suurem kui vajalik.
c) aine osa ei ole sulanud.
d) aine sisaldab lisandeid.
e) aine on 100% puhas.
Alternatiivne



