Linus Paulingi 1960. aastal loodud orbitaalide mudeli järgi moodustab kovalentne side molekulid tekivad molekulis osalevate elementide mittetäielike orbitaalide sulandumisel või läbitungimisel Link. Seega järeldatakse, et kui elemendil on mittetäielik orbitaal (ainult ühe elektroniga), saab see luua ainult kovalentse sideme. Kui sellel on kaks mittetäielikku orbitaali, saab see luua maksimaalselt kaks ühendust jne.
Kuid vaadake süsinikuaatomi elemendi aatomi orbitaale, mille aatomnumber on 6 (Z = 6):
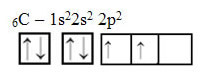
Pange tähele, et sellel on kaks mittetäielikku orbitaali, seega peaks see teostama ainult kahte sidumist. Temaga aga nii ei juhtu. Nagu paljud teavad, loob süsinik neli sidet (see on neljavalentne), mistõttu see orbitaalide mudel ei selgita süsiniku juhtumit.
Selle ummikseisu lõpetamiseks loodi uus teooria, mis seda küsimust paremini selgitas: Hübridiseerumise teooria.

See tähendab, et hübridiseerimine on puhaste orbitaalide “segu”.
Süsiniku jaoks on kolme tüüpi hübridisatsiooni, milleks on: sp3, sp2 ja sp.
Hübriidimise toimumise mõistmiseks vaatame süsiniku hübridisatsiooni esimest tüüpi, sp-tüüpi.3:
Seda tüüpi hübridisatsioon toimub metaanimolekulis (CH4). Pange tähele, et süsiniku, mis on keskne element, ja nelja vesiniku vahel on neli ühesugust kovalentset sidet. Niisiis, vaadake, mis on mittetäielik vesiniku orbitaal:
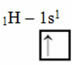
Kuna igal vesinikul on puudulik s-tüüpi orbitaal, on vaja vastu võtta veel üks elektron, see tähendab, et igaüks loob süsinikuga ainult ühe kovalentse sideme. Sellepärast peab süsinikul olema neli mittetäielikku orbitaali. Kuidas see juhtub? Hübridiseerimise kaudu.
Kui orbiidi 2s elektron neelab energiat, läheb see tühja 2p orbitaali. Seega ütleme, et see elektroni hüpe 2s-st 2p-i alatasemele on elektroni “edendamine”. Sel viisil jääb süsinik põnevil või aktiveeritud olekus, kusjuures kovalentsete sidemete teostamiseks on saadaval neli hübridiseeritud orbitaali:
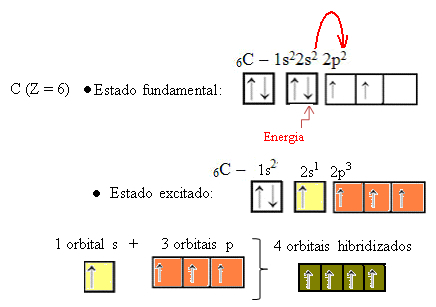
Pange tähele, et moodustunud hübriidsed orbitaalid on üksteisega samaväärsed, kuid erinevad algsetest puhastest orbitaalidest.
Sel viisil tekib side kõigi nelja vesinikuaatomi s orbitaali vahel nende nelja hübridiseeritud süsinikuorbiidiga:
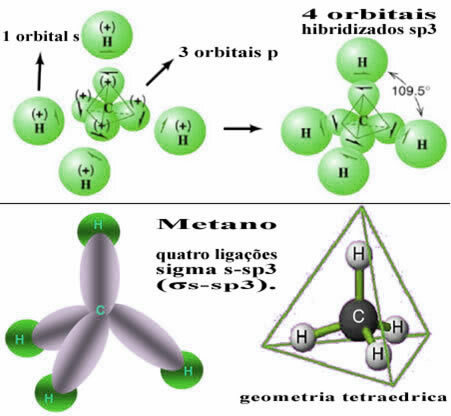
Nagu eespool näha, on metaanimolekulil korrapärane tetraeedristruktuur, mille igas tipus on neli elektronpilve ja külgnevad nurgad on 109 ° 28 ’. Kuna side tekkis iga vesiniku s orbitaali ja hübridiseeritud sp orbitaali vahel3 iga ühenduse jaoks on meil need olemas neli sigma s-sp linki3 (σs-sp3).
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm
