Termodünaamika kolmas seadus käsitleb aine käitumist entroopiaga, mis läheneb nullile.
Selle seaduse kohaselt läheneb selle entroopia nulli, kui süsteem on termodünaamilises tasakaalus.
Termodünaamika teine seadus on seotud entroopiaga. Seejärel ilmub kolmas seadus kui a katse luua absoluutne võrdluspunkt, mis määrab entroopia.
Walther Nernst (1864-1941) oli füüsik, kes tegeles põhimõtetega, mis moodustasid kolmanda termodünaamikaseaduse aluse.
Nernsti sõnul kipuks entroopia olema minimaalse väärtusega, kui puhta aine temperatuur oleks võrdne absoluutse nulliga või läheneks sellele.
Selleks pakkus Nernst välja järgmise valemi, mis näitab, et entroopia (ΔS) ja temperatuuri (T) varieerumine kipub olema minimaalne, see tähendab 0:
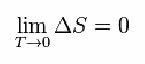
Aga mis on Entropia?
Entroopia see on viis, kuidas molekulid end süsteemis korrastavad. See organisatsioon tõlgib häireid mitte segaduse, vaid molekulide liikumise ja agiteerimise mõttes.
Mida rohkem molekule saab liikuda, seda rohkem on nad organiseerimata, seda rohkem on entroopiat.
Esialgu soovitas Nernst, et tema pakutud entroopia oleks võimalik ainult täiuslikel kristallidel.
Lõpuks jõudis ta järeldusele, et absoluutse nulliga võrdset temperatuuri ei eksisteeri, mis muudab kolmanda seaduse vaieldavaks seaduseks.
Nii et paljude füüsikute jaoks pole see seadus, vaid reegel.
Nii paljude aastate pärast (alates 1912. aastast) püüavad teadlased saada seda temperatuuri või temperatuure, mis tulevad üha lähemale absoluutsele nullile. Nii avastasid nad, et see on võimalik ainult gaasides, visates ära kõik tahkes või vedelas olekus olevad ained.
Loe ka:
- Termodünaamika nullseadus
- Esimene termodünaamika seadus
- Termodünaamika teine seadus
- Harjutused termodünaamikast