Kas olete kunagi märganud, et varsti pärast salati maitsestamist hakkavad köögiviljad närbuma? See juhtub väga levinud protsessi tõttu osmoos.
et saaksime aru mis on osmoos, kõigepealt peame teadma mõnda olulist mõistet, näiteks lahustunud aine ja lahusti. See viimane termin tähistab ainet, mis on võimeline teisi lahustama, näiteks vett. Soluut on seevastu aine, mis lahustatakse lahusti, näiteks soola abil.
Kui lahuses on palju lahustunud ainet, ütleme, et keskkond on hüpertooniline; ja kui lahustunud ainet leidub väikeses koguses, siis ütleme, et sööde on hüpotooniline. keskel on isotooniline kui lahustunud aine ja lahusti kontsentratsioon on ühesugune.
THE osmoos on rakkude vahel väga levinud protsess ja seda iseloomustab vee liikumine läbi membraan vähem kontsentreeritud (hüpotoonilisest) keskkonnast kontsentreeritumaks (hüpertooniliseks) keskkonnaks. Lahusti läbib rakumembraani ja migreerub piirkonnast, kus seda leidub suuremas koguses, kohta, kus seda esineb vähem.
Kujutage uuesti ette salatinäidet. Soola manulusel on väliskeskkonnas suurem lahustunud aine kogus, see tähendab, et see muutub hüpertooniliseks. Seejärel lahkub vesi osmoosi teel taimerakkudest, püüdes jätta sise- ja väliskeskkonnast sama koguse soluuti ja lahustit.
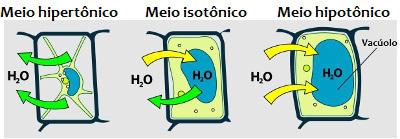
Analüüsige vee liikumist rakku või rakust välja erinevates keskkondades *
Kujutage nüüd ette veel ühte olukorda: panete a kamber taim hüpotoonilises keskkonnas ja varsti pärast seda märkab, et raku suurus on suurenenud. Mis sel juhul juhtus?Täpselt nii! Vesi rändas väliskeskkonnast raku sisekeskkonda, kuna rakusisese keskkond on hüpertooniline. Kui see sama rakk asetataks hüpertoonilisse keskkonda, kaotaks rakk vett, nii et see närbuks.
Nüüd teate, miks salat soola lisamisel närbub: ta kaotab osmoosi tõttu vett! Seetõttu vältige maitseaine enne serveerimist liiga pikka aega panemist, sest nii serveerite palju ilusamat ja maitsvamat toodet.
* Pildikrediit: Wikimedia Commons
Ma Vanessa dos Santose poolt



