Perioodiline tabel on viis kõigi keemiliste elementide korraldamiseks vastavalt nende omadustele ja nende kohta mõningase teabe kuvamisele.
Igapäevaelus on organiseerimine meie elu lihtsustamiseks väga oluline. Kujutage näiteks ette, et teie kapp on räpane, sokkidega segatud särgid ja püksid. See oleks väga keeruline ja konkreetse soki leidmine, mida soovite kanda, võtab rohkem aega, kas pole?! Aga kui korraldate oma garderoobi ja panete kõik sokid ühte sahtlisse, siis pidage sahtlit. t-särkide, teine lühikeste pükste jms jaoks on palju lihtsam leida mida vajadus. Ja mida rohkem riideid teil on, seda rohkem on vaja organiseeritust.
Samamoodi on teadlased aja jooksul avastanud paljusid keemilisi elemente. Idee andmiseks oli 1850. aastal teada umbes 60 elementi, kuid täna teame 118 olemasolu. Seega tekkis vajadus neid keemilisi elemente korraldada viisil, mis hõlbustaks nende omaduste mõistmist. See on keemiliste elementide perioodilisustabeli roll.
Perioodiline tabel, mida täna kasutame, on paigutatud horisontaalsetesse joontesse aatomnumbri kasvavas järjekorras.
Peaksite perioodilisustabeliga tutvuma, nagu loeksite tavalist teksti, st alati algab esimese reaga ja vasakult küljelt paremale ning jätkab seejärel järgmisele read.Keemilised elemendid paigutati Perioodilisustabelile eraldi ruutudena, kus elemendi sümbol asub pool ja aatomnumbri väärtus on tavaliselt kirjutatud ülaosas, nagu on näidatud allpool toodud vesiniku näites:

Vesiniku sümbol ja selle aatomnumber, nagu on näidatud perioodilisustabelis
Aatomnumber on prootonite või positiivsete laengute hulk, mis elemendi aatomitel on. See väärtus on võrdne elektronide arvuga, kui aatom on põhiolukorras.Vesinik on element, millel on ainult 1 prooton, see tähendab, et selle aatomnumber on 1. Seetõttu on vesinik esimene tabelisse pandud element. Järgmine vesinikuga samal joonel paiknev element on heelium, kuna selle aatomnumber on võrdne 2-ga.
Alumisele reale liikudes on esimene liitium, mille aatomnumber on 3, selle kõrval on berüllium aatomnumbriga 4 ja nii edasi.Vaadake allpool toodud perioodilise tabeli esimesi ridu ja vaadake, et aatomnumbri järjestus kasvab täpselt õiges suunas.
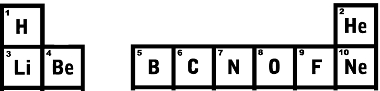
Perioodilisustabeli kaks esimest rida
Perioodilisustabelis on seitse rida ja neid ridu nimetatakse perioodidel. Vaata:

Perioodilise tabeli perioodid
Siin on 18 veergu, mida kutsutakse peredele või rühmadele. Oluline aspekt on see ühte perekonda kuuluvad elemendid, millel on sarnased füüsikalised ja keemilised omadused.

Perioodilised tabelid Pered või rühmad
Vaatame, kas saate aru? Öelge mulle, milline keemiline element kuulub 4. perioodi ja perekonda 16?
Kui ütlesite Se (seleen), on teil õigus! Nüüd öelge mulle, mis on tema aatomnumber. Täpselt nii, see on 34.
Igas väikeses ruudus, mida element näeb, on ka muud olulist teavet, näiteks aatommass ja elektronid mis asuvad igas aatomite elektroonilises kihis. Näiteks vaadake järgmisel pildil, et neooni sümboliks on Ne, selle aatomnumber on võrdne 10, aatomimass on 20,1797 u ja elektronid jaotuvad oma kihtidesse niimoodi: 2 - 8, see tähendab, et tuumale lähimas kihis on kaks elektroni ja kõige kaugemas kaheksa elektronid.

Neoonisümbol perioodilisustabelis ja selle aatom
Pange nüüd tähele kahte huvitavat aspekti: (1) ainult neoonil on kaks orbiiti või kihid, kus teie elektronid on, sellepärast ta hõivab 2. perioodi (2. rida);ja (2) tal on kaheksa elektroni viimasel kihil, sellepärast ta on pere 18.
See näitab meile järgmist:
* Perioodilisustabeli samal perioodil olevatel elementidel on sama palju elektroonilisi kihte ja neid võib olla maksimaalselt seitse;
* Perioodilisustabelis samas perekonnas paiknevatel keemilistel elementidel on viimases elektronkestas sama arv elektrone:
* Perekond 1: on kõik olemas 1 elektron viimases elektroonilises kihis;
* Perekond 2: on kõik olemas 2 elektroni viimases elektroonilises kihis;
* 13. pere: on kõik olemas 3 elektroni viimases elektroonilises kihis;
* 14. pere: on kõik olemas 4 elektroni viimases elektroonilises kihis;
* Perekond 15: on kõik olemas 5 elektroni viimases elektroonilises kihis;
* 16. pere: on kõik olemas 6 elektroni viimases elektroonilises kihis;
* Perekond 17: on kõik olemas 7 elektroni viimases elektroonilises kihis;
* Perekond 18: on kõik olemas 8 elektroni viimases elektroonilises kihis.
Mõnele perioodilise tabeli rühmale või perekonnale antakse konkreetsed nimed, vaata mõnda:
1. pere: Leelismetallid;
2. pere: Leelismuldmetallid;
16. pere: Kalkogeenid;
17. pere: Halogeenid;
18. pere: Väärisgaasid.

Perioodiliste tabelite perede korraldamine
Jällegi proovime teie teadmisi. Vastake järgmistele küsimustele, vaadates lihtsalt perioodilisustabelit:
1 - Mis on klooriperekonna nimi?
2- Mis on selle aatomnumber ja aatomimass?
3- Mitu elektroonilist kihti on klooriaatomil?
4- Mitu elektroni on kloori aatomil viimases elektronkestas?
Vastused:
1- Halogeenid (perekond 17).
2- kloori aatomnumber on 17 ja selle aatomimass on 35,45 u.
3- Klooriaatomil on kolm elektroonilist kihti, kuna see kuulub tabeli 3. perioodi.
4- kloori aatomil on valentskoores seitse elektroni, kuna see kuulub perekonda 17.
On veel muud olulist teavet, mida Perioodilisustabel meile edastab ja millest räägime hilisemates tekstides paremini. Kuid siin käsitletud on peamised, et saaksite aru saada, kuidas elemendid selles on korraldatud. Pidage meeles, et lauda ei tehta kaunistamiseks, kuid peate seda hästi teadma, et saaksite sellele vajaduse korral viidata.
Autor Jennifer Fogaça
Lõpetanud keemia
Kasutage võimalust ja vaadake meie teemaga seotud videotunde:


