Isomeeria see on loomulik nähtus, kus erinevatel ainetel (keemiliste ja füüsikaliste omaduste poolest) on täpselt sama molekulaarne valem nagu järgmises näites:
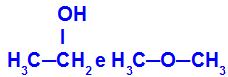
Erinevad ained, millel on sama molekulivalem
Etanoolil (vasakul) on molekulvalem C2H6O, mida esineb ka metoksüetaani korral (paremal), seega on need isomeerid.
Isomeeria tüübid
→ lame isomeer
Isomeeride tüüp uurib isomeeride vahelisi struktuurilisi erinevusi.
) Okupatsioon
See on lame-isomeeria tüüp, milles ainete erinevus põhineb nende orgaaniliste funktsioonide erinevusel, kuhu nad kuuluvad. Vaadake mõnda näidet:
Propanoon ja propaan:
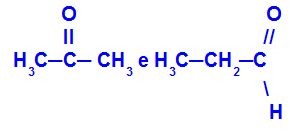
Erinevatesse funktsioonidesse kuuluvad isomeerid
Propanoon (vasakul) kuulub ketoonrühma ja propanaal (paremal) aldehüüdirühma.
B) Vangla
See on lame isomeeria tüüp, kus ainete erinevus põhineb nende esinevate ahelate erinevusel. Vaadake näidet:
2-metüül-propaan ja butaan
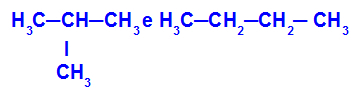
Isomeerid, millel on erineva klassifikatsiooniga ahelad
Näites näeme, et 2-metüül-propaanil (vasakul) on hargnenud ahel ja butaanil (paremal) on tavaline ahel.
ç) Positsioon
See on lame isomeeria tüüp, kus ainete erinevus põhineb nende ahelates oleva komponendi asukoha erinevusel. Vaadake näidet:
1-kloropropaan ja 2-kloropropaan
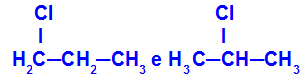
Isomeerid, millel on komponendid ahela erinevates kohtades
Näites näeme, et 1-kloropropaanil (vasakul) on kloor süsinikul 1 ja 2-kloropropaanil (paremal) kloor süsinikul 2.
d) Metameria või hüvitis
MÄRGE: Isomeer kehtib ainult heterogeensete stringide puhul.
See on lame isomeeria tüüp, mille puhul ainete erinevus põhineb nende ahelates oleva heteroaatomi positsiooni erinevusel. Vaadake näidet:
Näide: Metoksüpropaan ja etoksüetaan
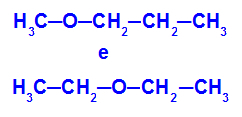
Isomeerid, millel on heteroaatomid ahela erinevates positsioonides
Näites näeme, et metoksüpropaanis (vasakul) on hapnikul radikaal, mille ühel küljel on üks süsinik ja teisel küljel kolm süsinikku. Etoksüetaanis (paremal) on hapnikul radikaal, mille ühel ja teisel küljel on kaks süsinikku.
ja)Tautomeeria
See on konkreetne tasapinnalise funktsiooni isomeeria juhtum ja see esineb ainult kolmes orgaanilises funktsioonis:
Aldehüüd
ketoon
Enol
Seda tüüpi isomeeria toimib asjaolul, et enooli ja aldehüüdi ning enooli ja ketooni vahel on keemiline tasakaal, see tähendab, et need komponendid muudetakse pidevalt üksteiseks. Vaadake näidet:
Prop-2-een-1-ool ja propanoon
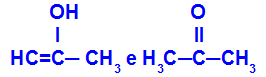
Erinevatesse funktsioonidesse kuuluvad isomeerid
Näites näeme, et Prop-2-een-1-ool (vasakul) kuulub enoolide rühma ja propanoon (paremal) ketoonide rühma, seega on nad tautomeeria isomeerid.
→ Kosmose isomeeria
See on molekuli ruumianalüüsiga määratletud isomeeriatüüp.
a) geomeetrilised isomeerid
Ärge lõpetage kohe... Peale reklaami on veel;)
See on teatud tüüpi isomeeria, mis tekib siis, kui ainel on järgmiste omadustega molekulid:
Suletud ahel, millel on kaks süsinikku koos kahe erineva ligandiga, nagu allpool toodud näites:

Suletud struktuur geomeetrilise isomeeriga
Avatud ahel, millel on süsinike vahel kaksikside, ja igas neist kaksiksideme süsinikust on kaks erinevat ligandit, nagu allpool toodud näites:
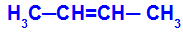
Geomeetrilise isomeeriaga avatud struktuur
Geomeetriline isomeeria on jagatud kahte rühma:
1O Grupp: cis-trans
See tekib siis, kui ühe süsiniku kaks ligandit on kas avatud või suletud struktuuris rangelt võrdsed teise süsiniku kahe ligandiga.
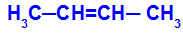
Cis-trans-isomeeriat omava aine ahel
Isomeeri nimetatakse cis-ks, kui samad ligandid asuvad samas tasapinnas.

Cis-isomeeri näide
Isomeeri nimetatakse trans-ks, kui erinevad ligandid asuvad samas tasapinnas.

Näide trans-isomeerist
2O Grupp: E-Z
See tekib siis, kui ühe süsiniku kaks ligandit on teise süsiniku kahe ligandi suhtes erinevad kas avatud või suletud struktuuris.

E-Z isomeeriat omava aine ahel
Isomeeri nimetatakse E-ks, kui suurima aatomnumbriga ligandid asuvad vastassuunas. Allpool toodud näites on vasakpoolsel süsinikul kõrgeima aatomnumbriga Br (35) ja teises on hapnik (8).
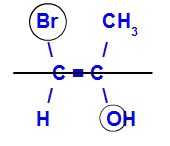
E-isomeeri näide
Isomeeri nimetatakse Z-ks, kui kõrgeima aatomnumbriga ligandid asuvad samal tasapinnal. Allpool toodud näites on vasakpoolsel süsinikul kõrgeima aatomnumbriga Br (35) ja teises on hapnik (8).

Z-isomeeri näide
B) optiline isomeer
See on teatud tüüpi isomeeria, mis tekib ainult siis, kui ainel on molekule kiraalne süsinik (sellel, millel on neli erinevat ligandit) nende struktuurides. Kiraalse süsinikuga molekulil on võime polariseerida ja valgust kõrvale juhtida järgmiselt:
Paremale (parempoolne isomeer)
Vasakule (pöörlev isomeer)
Optilise aktiivsusega ühendil on alati aktiivsed isomeerid (nn optilised antipoodid) ja inaktiivsed isomeerid (segu kahe aktiivse isomeeri vahel, segu, mida nimetatakse ratseemiliseks).
Kiraalse süsinikuga ühendi aktiivsete (IOA) ja mitteaktiivsete (IOI) isomeeride arvu määramiseks võime kasutada järgmist valemit:
IOA = 2ei
IOI = 2ei
2
Allpool on näide ühendist, millel on geomeetriline isomeeria:
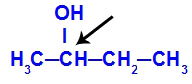
2-butaan-2-olis sisalduv kiraalne süsinik
Butaan-2-ooli struktuuril on järgmised ligandid:
Metüül (CH3)
Etüül (CH3-CH2)
Vesinik (H)
Hüdroksüül (OH)
Kuna sellel on ainult üks kiraalne süsinik, on butaan-2-oolil:
Aktiivsed isomeerid:
IOA = 21
IOA = 2
Mitteaktiivsed isomeerid:
IOI = 21
2
IOI = 2
2
IOI = 1
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Mis on isomeeria?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Juurdepääs 27. juunil 2021.