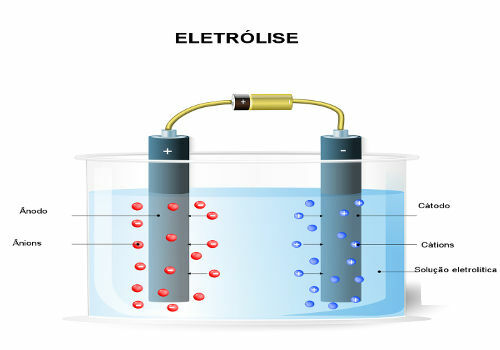
Tekstis Elektrolüüsi kvantitatiivsed aspektid, nägite mõningaid matemaatilisi seoseid, mis on loodud elektrolüüsiprotsessis osalevate suuruste vahel, näiteks elektrivool (i), protsessi toimumiseks vajalik elektrilaengu kogus (Q) ja aeg (t) viia. Samuti avastati elektrilaengu kogus, mis kandub siis, kui elektrone on 1 mool või vastavalt Avogadro konstandile 6.02. 1023 elektronid.
Lühidalt öeldes on suhted järgmised:

Nüüd on siin kolm näidet, kuidas seda teavet kasutada praktiliste elektrokeemiliste probleemide lahendamiseks. Oluline on märkida, et siin kasutame väärtust 96486 C. Enamikus keemiakirjandustes kasutatakse siiski ümardatud väärtust 96500 C.
1. näide: Vaatleme galvaanilist plaati, mille osa on kaetud hõbedaga. Selle elektrolüütilise protsessi lõpus on Ag-ioonide jaoks kasutatud laengu suurus+ kui nad vähendaksid Ag-d, oli see tänapäeval 0,05. Teades, et hõbeda molaarmass on võrdne 108 g / mol, öelge, kui suur oli selle protsessi käigus sadestunud hõbeda mass?
Resolutsioon:
Ag+ (siin) + ja- → Ags)
↓ ↓
1 mol e-1 mol
↓ ↓
1 faraday 108 g
0,05 faraday m
m = 5,4 g
2. näide: Oletame, et teeme nikli sulfaadi vesilahuse (NiSO4), rakendades 386 sekundi jooksul 0,10 A elektrivoolu. Kui suur on katoodi juures saadav nikli mass? (Arvestades: Ni molaarmass = 58,7 g / mol)
Resolutsioon:
Ni2+ + 2e- → Nis)
↓ ↓
2 mol e-1 mol
↓ ↓
2 (96486 C) 58,7 g
Kolme reegli loomiseks ja antud juhul moodustunud massi leidmiseks peame kõigepealt leidma elektrilaengu suuruse (Q):
Q = i. t
Q = 0,10. 386
Q = 38,6C
Nii et meil on:
2 (96486 C) 58,7 g
38,6 cm
m = 2265,82C. g
192972 ° C
m = 0,01474 g või 11,74 mg
3. näide: Meil on kolm elektrolüütilist anumat järjestikku ühendatud ja allutatud 5 A voolule 32 minutiks ja 10 sekundiks. Esimeses vaatis on meil CuSO lahendus4; teisel on meil FeCl lahus3; ja kolmandas on meil AgNO lahendus3. Määrake kolme süvendi elektroodidele sadestatud metallide mass. (Molaarmassid: Cu = 63,5 g / mol, Fe = 56 g / mol, Ag = 108 g / mol).
Ärge lõpetage kohe... Peale reklaami on veel;)
Resolutsioon:
Esmalt edastame ajaväärtuse sekunditesse:
1 minut 60 sekundit
32 minutit t
t = 1920 + 10 sekundit = 1930 sekundit
Nende andmete abil saame määrata elektrilaengu suuruse Q:
Q = i. t
Q = 5. 1930
Q = 9650 ° C
Nüüd kasutame sadestunud metallide vastavate masside väljaselgitamiseks kolme vaagis esineva poolreaktsiooni kohta kolme reeglit:
1. Kuuba: 2. Kuuba: 3. Kuuba:
Perse2+ + 2e- → Cus) Usk3+ (siin) + 3 ja- → Fes) Ag+ (siin) + ja- → Ags)
↓ ↓ ↓ ↓ ↓ ↓
2 mol e-1 mol 3 mol e- 1 mol 1 mol e-1 mol
↓ ↓ ↓ ↓ ↓ ↓
2. (96486 C) 63,5 g 3. (96486 C) 56 g 96486 C 108 g
9650 C m 9650 C m 9650 C m
m = 3,175 g Cus)m - 1,867 g Fes)m = 10,8 g Ags)
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Elektrolüüsi kvantitatiivsete aspektide rakendused"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/aplicacoes-dos-aspectos-quantitativos-eletrolise.htm. Juurdepääs 28. juunil 2021.
Keemia

Elektrolüüsi, galvaniseerimise, nikeldamise, kroomimise, nikli, kroomi, katoodi, naatriumi, alumiiniumi, kloori, seebikivi, gaasiline vesinik, tardelektrolüüs, vesilahus, leelismetallid, leelismuld, gaas kloor.
Keemia

Elektrolüüs, elektrolüütide lahused, elektrivool, oksüdatsiooni-redutseerimise reaktsioonid, spontaanne keemiline protsess, keemiline protsess mittespontaanne, trafo, kunstlik muundamine, tööstused, leelismetallid, leelismuld, vesinikgaas, gaas kl