Nitraadid on anorgaanilised ühendid, mis sisaldavad aniooni NO3-.
Lämmastik kuulub perekonda 15, valentskoores on 5 elektroni ja see peab moodustama kolm kovalentset sidet (koos elektronide jagamisega), et valentskoores oleks kaheksa elektroni ja seeläbi püsima stabiilne. Igas hapnikus on viimases kestas aga 6 elektroni ja seetõttu peavad kõik selle aatomid stabiilsuse tagamiseks looma kaks sidet.
Niisiis, nitraatanioonis on lämmastik keskne element, mis loob kaksiksideme ühe oksügeeniga, mis on stabiilne, üks side kahe ülejäänud oksügeeniga ja teine kovalentne side dateeriv. See tähendab, et üks oksügeenidest ei ole stabiilne ja vajab veel 1 elektroni vastuvõtmist, andes kogu laenguks -1. Datiivlämmastik loob sideme rohkem kui suudaks, annetades ühe oma elektronidest, saades laenguks võrdse +1. Vaadake selle aniooni struktuuri allpool:
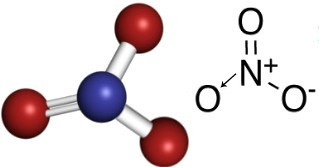
See anioon võib vastu võtta elektroni ja moodustada elektriliselt neutraalse ühendi, anorgaanilise soola. Need ühendid on kõik vees lahustuvad.
Nitraatide peamised kasutusalad on ravimid, näiteks vasodilataatorid stenokardia (valu põhjustatud vähesest hapnikuvarustusest südamelihase verevoolu tõttu) ja erektsioonihäiretest mees. Neid kasutatakse ka väetistes ja lõhkeainetes, nagu hiljem mainitakse.
Nitraate saab toota lämmastikhappe (HNO) neutraliseerimise reaktsiooni abil.3) mingil alusel. Vaadake allpool toodud näidet, kus moodustati magneesiumnitraat:
HNO3 + Mg (OH)2 → Mg (EI3)2+ H2O
Seda tüüpi ühendite kolm peamist näidet on naatriumnitraat (NaNO3), kaaliumnitraat (KNO3) ja ammooniumnitraat (NH4JUURES3). Kõigil neil juhtudel katioonid (Na+, K+ ja NH4+) annab nitraataniooni jaoks 1 elektroni. Kuid tegelikkuses tõmbavad need vastupidised laengud üksteist ligi ja moodustavad täpselt määratletud ioonkobarad, mis on kristallvõred. Seega on nitraadid tavaliselt kristalsed tahked ained, nagu naatriumnitraadi puhul allpool näidatud:
Ärge lõpetage kohe... Pärast reklaami on veel rohkem;)
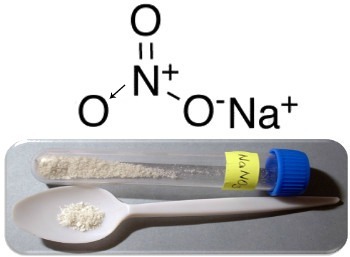
Seda ühendit kasutatakse väetiste tootmisel, kuid seda tuntakse peamiselt kui Tšiili salpett, kuna Tšiili kõrbetes on sellest suuri hoiuseid. See muundatakse kaaliumnitraadiks, mida kasutatakse mitmesugustes relvades ja lõhkeainetes kasutatava musta pulbri valmistamiseks.

Nii naatriumnitraati kui ka kaaliumnitraati nimetatakse "salpetreks", mida kasutatakse laialdaselt konserveeritud ja suitsutatud liha säilitusained, samuti mõnes toidus suurema tunde andmiseks küllastumine. Kuid selle tarbimine kahjustab tõsiselt tervist, kuna bakterid võivad neid nitraate muundada organism nitrititeks ja hiljem nitrosoamiinideks, mis on kantserogeensed, põhjustades peamiselt kõht. Nitritid muundavad ka vere hemoglobiinid, mistõttu nad ei suuda hapnikku kanda.
Nitraatide liigse tarbimise peamised põhjused on lämmastikväetiste kasutamine köögiviljade kasvatamisel.
Saltpeter on ohtlik ka seetõttu, et see suurendab naatriumioonide kontsentratsiooni kehas, mis võib põhjustada südameprobleeme nagu kõrge vererõhk.
O ammooniumnitraat seda kasutatakse ka väetisena ja lõhkeainena ning seda kasutati isegi 11. septembril 2001 Maailma Kaubanduskeskuse hoonete vastu suunatud terrorirünnakus koos kütteõliga.

Rünnakus Maailma Kaubanduskeskusele kasutati ammooniumnitraati *
* Pildi autoriõigus: Dan Howell ja Shutterstock.com
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Nitraadid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/nitratos.htm. Juurdepääs 27. juunil 2021.
Keemia

Igapäevased soolad, kaltsiumkarbonaat, naatriumkloriid, naatriumfluoriid, kaaliumnitraat, naatriumnitraat naatrium, naatriumkarbonaat, naatriumvesinikkarbonaat, naatriumvesinikkarbonaat, naatriumsulfit, soolapeter, sooda.